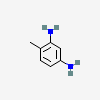Os adaptógenos são substâncias naturais encontradas somente em umas planta. Essas plantas denominadas de especiais que ajudam a atingir a atingir um rendimento mental e físico, principalmente no dia a dia do ser ser humano. O Dr. Nicolai Lazarev (Russo), foi quem denominou de "adaptógeno", em 1947.
A Teoria Sistémica
Um adaptógeno, segundo a Teoria Sistémica, é qualquer substância capaz de incrementar a saúde atavés do fornecimento Energia, melhora da Inteligência (função e estrutura) de qualquer sistema biofísico; e em particular o corpo humano. Por definição, um adaptógeno não deve causar efeitos secundários, deve ter efeito modulador, não pode causar vício e deve transferir suas propriedades de sobrevivência de quem o ingere. A diferença entre um adaptógeno e uma planta medicinal é que o primeiro, por definição, não deve causar efeitos secundários.
segunda-feira, 27 de setembro de 2010
domingo, 28 de fevereiro de 2010
ANSIEDADE, DEPRESÃO E AS PLANTAS MEDICINAIS
ANSIEDADE
A ansiedade é um sinal de advertência, que serve para avisar de um perigo eminente, e permite ao indivíduo tomar medidas para lidar com a ameaça (conflito interno ou externo). O medo é um sinal de aviso de algo real. A diferença em relação à ansiedade é que o perigo é conhecido, com uma resposta a uma ameaça conhecida. Ansiedade é uma resposta a uma ameaça desconhecida, uma fonte de conflito interno.
A ansiedade manifesta-se em diferentes planos: psicológico, fisiológico e comportamental (Graeff, 1997). A ansiedade é uma vivência comum de qualquer ser humano. A sensação se caracteriza por um sentimento difuso, desagradável, e vago de apreensão, freqüentemente, acompanhado por sintomas autonômicos, como cefaléia, perspiração, palpitações, aperto no peito e leve desconforto abdominal.
A grande variedade de sintomas presentes durante a ansiedade tende a variar entre as pessoas. A ansiedade é uma resposta a uma ameaça desconhecida, interna ou externa, vaga ou de origem conflituosa. A ansiedade quando considerada simplesmente como um sinal de alerta, pode ser encarada como uma emoção semelhante ao medo, podendo preparar o indivíduo para tomar medidas necessárias, para evitar a ameaça ou, pelo menos, atenuar suas conseqüências (Kaplan et al, 1997). A Organização Mundial de Saúde na sua décima edição da Classificação Estatística e Internacional de Doenças e Problemas Relacionados à Saúde (CID-10) agrupam os seguintes transtornos de ansiedade:
→AGORAFOBIA
O transtorno ansioso social, também conhecido como transtorno da ansiedade social, fobia social ou sociofobia. O que ocorre quando o portador precisa interagir com outras pessoas, realizar desempenhos sob observação ou participar de atividades sociais. Tudo isso ocorre até o ponto de interferir na maneira de viver de quem a sofre. As pessoas afetadas por essa patologia compreendem que seus medos são irracionais. Por conta disso, tendem freqüentemente a se isolarem.
→FOBIAS SOCIAIS
O transtorno ansioso social, também conhecido como transtorno da ansiedade social, fobia social ou sociofobia. O que ocorre quando o portador precisa interagir com outras pessoas, realizar desempenhos sob observação ou participar de atividades sociais. Tudo isso ocorre até o ponto de interferir na maneira de viver de quem a sofre. As pessoas afetadas por essa patologia compreendem que seus medos são irracionais. Por conta disso, tendem freqüentemente a se isolarem.
→FOBIAS SOCIAIS
O transtorno ansioso social, também conhecido como transtorno da ansiedade social, fobia social ou sociofobia. O que ocorre quando o portador precisa interagir com outras pessoas, realizar desempenhos sob observação ou participar de atividades sociais. Tudo isso ocorre até o ponto de interferir na maneira de viver de quem a sofre. As pessoas afetadas por essa patologia compreendem que seus medos são irracionais. Por conta disso, tendem freqüentemente a se isolarem.
→FOBIAS ESPECÍFICAS
Anteriormente denominada fobia simples a fobia específica é o medo persistente e recorrente a um determinado objeto ou circunstância que desencadeia uma forte reação de ansiedade, sempre que apresentado ao paciente fóbico.
→TRANSTORNO DO PÂNICO
O transtorno do pânico ou síndrome do pânico é uma condição mental psiquiátrica que faz com que o indivíduo tenha ataques de pânico esporádicos, intensos e muitas vezes recorrentes. Pode ser controlado com medicação e psicoterapia. É importante ressaltar que um ataque de pânico pode não constituir doença (se isolado) ou ser secundário a outro transtorno mental. O tratamento do transtorno do pânico inclui medicamentos e psicoterapia. O uso de uma nova técnica denominada estimulação magnética transcraniana repetitiva também vem sendo indicado.
→ANSIEDADE GENERALIZADA O transtorno de ansiedade generalizada é basicamente uma preocupação ou ansiedade excessiva, ou com motivos injustificáveis ou desproporcionais ao nível de ansiedade observada. Para que se faça o diagnóstico de ansiedade generalizada é preciso que outros transtornos de ansiedade estejam. É preciso que essa ansiedade excessiva dure por mais de seis meses continuamente.
→TRANSTORNO MISTO - ANSIOSO E DEPRESSIVO
Esta categoria deve ser utilizada quando o sujeito apresenta ao mesmo tempo sintomas ansiosos e sintomas depressivos, sem predominância nítida de uns ou de outros, e sem que a intensidade de uns ou de outros seja suficiente para justificar um diagnóstico isolado.
→TRANSTORNO OBSESSIVO-COMPULSIVO
O transtorno obsessivo-compulsivo (TOC) é um quadro psiquiátrico caracterizado pela presença de obsessões e compulsões. Sua prevalência é de aproximadamente 2% a 3% na população geral. Os fatores genéticos estão provavelmente implicados na etiologia do transtorno. Os estudos realizados sugerem que há diferentes subtipos de TOC: TOC com história familiar positiva para TOC, TOC "esporádico" e TOC associado com a tiques.
O transtorno obsessivo-compulsivo (TOC) é um quadro psiquiátrico caracterizado pela presença de obsessões e compulsões. Sua prevalência é de aproximadamente 2% a 3% na população geral. Os fatores genéticos estão provavelmente implicados na etiologia do transtorno. Os estudos realizados sugerem que há diferentes subtipos de TOC: TOC com história familiar positiva para TOC, TOC "esporádico" e TOC associado com a tiques.
Já o Manual Diagnóstico e Estatístico de Transtornos Mentais da Associação Norte-Americana de Psiquiatria, na sua quarta versão, (DSM-IV), classifica os transtornos de ansiedade nos seguintes tipos:
→Transtorno de pânico sem agora fobia,
→Transtorno de pânico com agora fobia,
→Fobia específica,
→Fobia Social,
→Transtorno obsessivo-compulsivo,
→Transtorno de Estresse pós-traumático,
→Transtorno de estresse agudo,
→Transtorno de ansiedade generalizada,
→Transtorno de ansiedade devido a uma condição médica geral,
→Transtorno de ansiedade devido a uma substância,
→Transtorno de ansiedade sem outra especificação (American Psychiatric Association, 1994).
Pode-se concluir que os chamados transtornos de ansiedade são uns conjuntos de transtornos heterogêneos, com quadros clínicos e tratamentos diferentes, assim como os diferentes modelos animais de ansiedade abordam diferentes transtornos de ansiedade.
DEPRESSÃO
Depressão é uma doença marcada por mudanças extremas no comportamento, energia e ânimo de uma pessoa. Não é uma doença "de cabeça". Ela afeta tanto a mente quanto o corpo.
É bem diferente de estar triste ou "deprê". Sentimentos ocasionais de tristeza são normais e podem ter inúmeras causas. Na depressão, sentimentos de tristeza são fora de proporção e nem sempre se relacionam a causas externas. Pessoas que não sofrem de depressão lidam com seus problemas (internos e externos) sem ficarem incapacitadas.
O mesmo não acontece com depressivos. A doença interfere na habilidade pessoal de trabalhar, dormir, se relacionar, comer, de gostar de atividades antes consideradas prazerosas. A depressão tem tratamento, com sucesso em mais ou menos 80% dos casos.
A doença afeta pessoas de todas as raças, idades, situações econômicas e sexo. No entanto, metade das pessoas que sofrem de depressão não procura tratamento, o que leva a doença a ser a principal causa dos suicídios (segundo estatísticas americanas). Quem tem depressão não deve se sentir envergonhado. Depressão não são uma fraqueza de caráter ou um defeito.
COMO DIFERENCIAR DEPRESSÃO DE UMA TRISTEZA PASSAGEIRA?
Todo mundo passa por períodos de tristeza, que são uma parte normal da vida. Mas a severidade dos "episódios depressivos" e o seu poder de incapacitação do indivíduo são o que os distingue de um simples sentimento de tristeza. Se o que você sente está prejudicando de alguma forma a sua vida prática, é hora de procurar um médico.
CAUSA DEPRESSÃO
Sabe-se que a depressão é causada por um desequilíbrio químico no cérebro. O que não se sabe ao certo é o que causa esse desequilíbrio. Vários fatores (biológicos, sociais e psicológicos) podem contribuir para isso:
→Algumas pessoas podem ter uma predisposição genética. Por isso é importante saber se alguém na sua família tem ou teve a doença. Caso a resposta seja positiva, não significa, necessariamente, que esse seja o motivo conclusivo da sua doença. Existem pessoas com histórico de depressão na família que não chegam a desenvolvê-la.
→Pessoas com padrão negativo de pensamento (pessimismo, baixa auto-estima, preocupação em excesso, ansiedade em excesso) têm mais chance de desenvolver depressão.
→Algumas doenças, como câncer, mal de Parkinson e mal de Alzheimer (entre outras) podem desencadear a depressão.
→Situações extremas, como a morte de alguém querido, separação, problemas financeiros, mudança, podem contribuir para uma crise da doença.
→Alguns medicamentos podem causar depressão. É importante se informar a respeito, e sempre falar para o médico quais os remédios que você está tomando.
→Nenhum desses fatores é conclusivo. Para algumas pessoas, a depressão é causada por uma série deles, para outras, basta um. No entanto, independentemente dos fatores de causa, a depressão é uma doença que precisa ser diagnosticada e tratada.
TIPOS DE DEPRESSÃO
→TRANSTORNO BIPOLAR
O transtorno afetivo bipolar pode ser classificado, de acordo com o tipo do episódio atual, em hipomaníaco, maníaco ou depressivo. Os episódios maníacos são subdivididos de acordo com a presença ou ausência de sintomas psicóticos. O transtorno afetivo bipolar inclui ainda os episódios mistos
→DISTIMIA
American Psychiatric Association. Diagnostic and Statiscal Manual of Mental Disorders. 4th ed. Washington, DC: American Psychiatric Association; 1994.
Benjamin James Sadok and Virginia Acott Sadok. Compêndio de Psiquiatria: ciência do comportamento e psiquiatria clínica. Ed. Artmed 9a edition.
Frederico G. Graeff. 2002. Review: On serotonin and experimental anxiety. Psychopharmacology. 163 (3-4): 1432-2072.
Gelder, Michael; Mayou, Richard; Cowen, Philip. Tratado De Psiquiatria. 4ª Edição. Guanabara koogan 2006. pp 834.
Harold I. Kaplan and Benjamim. Compendio de Psiquiatria: Ciências comportamentais - Psiquiatria Clínica. Editora Arte Médicas. Porto Alegre - Brasil. 1993. pp 955.
VALERIANA
É um produto obtido da raiz de uma planta muito difundida na Europa, a Valeriana officinalis. Foi o principal sedativo usado tanto na Europa como na América, antes da descoberta do barbitúrico, nos anos iniciais do século 20. Caracteristicamente possui um odor forte e desagradável. É sem dúvida um importante sedativo, podendo ser usado como indutor do sono. Pode ser utilizado ainda como calmante durante o dia, e como sedativo para crianças.
o se conhece bem qual a sua substância ativa. É utilizado na forma de tintura. A dose recomendada como indutor de sono é de ±30 gotas de tintura, em água, ao deitar. Existe também em forma de cápsulas.
Como todo sedativo, tem ação depressora sobre o sistema nervoso, podendo provocar depressão. Não causa dependência, sendo menos potente do que os sedativos conhecidos. Pode aumentar a ação do álcool, não devendo ser associada ao mesmo.
O tratamento da ansiedade e dos problemas de sono deve ser observado outras formas terapêuticas que não a química ou a derivada de plantas. A tensão emocional responde muito bem a técnicas de relaxamento e a psicoterapia corporal, por exemplo. Os problemas de sono em geral são complexos e freqüentemente estão relacionados a graves problemas psicológicos como a depressão. Devemos sempre procurar orientação médica antes de utilizarmos medicamentos ou remédios. Antes de iniciarmos um tratamento devemos nos submeter à investigação profunda. Em geral há um medicamento ideal para cada pessoa, que deve ser utilizado em dose correta e sempre por um determinado tempo.
É muito comum em nosso meio a utilização de medicamentos sem orientação médica e por longo tempo. Muitas vezes ao se dirigir à consulta médica o paciente esquece-se de mencionar qual o produto que vem sendo utilizando. Um exemplo disto ocorre com laxantes naturais, muito utilizados e raramente citados. É interessante lembrar que inclusive o uso de pomadas deve ser mencionado.
Ao consultarmos um médico, ao iniciarmos um tratamento, ao realizarmos um procedimento cirúrgico, devemos informar sempre todos os medicamentos que estão sendo utilizados.
BIBIOGRAFIA
Adams P. 1998. "Drug interactions that matter. (1) Mechanisms and management." The Pharmaceutical Journal. 261: 618-621.
D'Arcy P. 1993. "Adverse reactions and interactions with herbal medicines. Part 2 - drug interactions." Adverse Drug Reactions and Toxicological Review. 12(3):147-162.
Ernst E. 2000. "Possible interactions between synthetic and herbal medicinal products. Part 1: A systematic review of the indirect evidence." Perfusion. 13: 4-15.
Featherstone C, Godden D, Gault C, Emslie M, Took-Zozaya M. 2003. Prevalence study of concurrent use of complementary and alternative medicine in patients attending primary care services in Scotland. American Journal of Public Health . 93(7):1080-1982.
Fugh-Berman A, Ernst E. 2001. "Herb-drug interactions: Review and assessment of report reliability." British Journal of Clinical Pharmacology. 52: 587-595.
K.A. Wesnes, T. Ward, A. McGinty and O. Petrini. 2000. The memory enhancing effects of a Ginkgo biloba/Panax ginseng combination in healthy middle-aged. Psychopharmacology. 152 (4): 353-361.
Lambrecht JE, Hamilton W, Rabinovich A. 2000. "A review of herb-drug interactions: Documented and theoretical." US Pharmacist: 25(8): 42-53.
T . Breidenbach , M . Hoffmann , T . Becker , H . Schlitt , J . Klempnauer. 2000. Drug interaction of St John's wort with ciclosporin. The Lancet , 355 (9218): 1912–1912.
Vladimir Vuksan, John L. Sievenpiper, Vernon Y. Y. Koo, Thomas Francis, Uljana Beljan-Zdravkovic, Zheng Xu, Edward Vidgen. 2000. American Ginseng (Panax quinquefolius L) Reduces Postprandial Glycemia in Nondiabetic Subjects and Subjects with Type 2 Diabetes Mellitus. Archives of Internal Medicine. 160: 1009-1013.
_________________________
ERVA DE SÃO JOÃO (ST. JOHN’S WORT)
Hypericum perforatum Guttiferae (Hiperricoidaea)
Erva de São João é amplamente distribuída na Europa, Ásia, África do Norte e foi aclimatado no U.S.A.
Durante séculos o Hypericum perforatum foi amplamente utilizada, inicialmente, por sua habilidade para curar feridas, úlceras na pele e queimaduras. Considerada capaz de afastar maus espíritos, também foi utilizada para tratar vários transtornos mentais. Atualmente a planta não é utilizada para esses fins, mas é amplamente utilizada com antidepressivo, contra os sintomas depressão leve, ansiedade, insônia, dor sensível, e ainda, atividades antivirais, e antibacterianas. Mais hoje sua principal ação é como antidepressivo.
O Hipericum perforatum, conhecido popularmente como Erva de São João ou hipérico, não pode ser utilizado sem supervisão médica. Isso porque a combinação com outros fármacos, como contraceptivos orais, ciclosporina (para evitar a rejeição em transplantes) e indinavir (para tratamento de AIDS), pode reduzir os efeitos das mesmas e interferi no tratamento do paciente. Outros medicamentos que podem perder os seus efeitos quando utilizados em conjunto com o Hipericum são: digoxina, teofilina e varfarina.
A droga baseada no Kawa Kawa e Erva de São João não pode ser vendida sem a faixa vermelha ou sem registro, se assim for devem ser retirados do mercado imediatamente. Sem o registro, não há como o Ministério da Saúde garantir a qualidade e a eficácia dos produtos à base dessas plantas, pois não existem dados analíticos sobre a biodisponibilidade na ANVISA. Os distribuidores devem prever a retirada de pontos de venda. Aqueles que desrespeitarem a suspensão podem receber multas e até o cancelamento da licença para operar o estabelecimento. A vigilância sanitária Federal e Estadual deve estar atenta e acompanhar a retirada de tais produtos nas farmácias e drogarias.
A estrutura da Hiperforina foi elucidada por um grupo de investigação do Shemyakin Institute of Bio-organic Chemistry (USSR Academy of Sciences in Moscow).
FARMACOLOGIA
Acredita-se que o Hiperforina seja principal componente ativo responsável pelo efeito antidepressivo dos extratos de St John's Wort. Hiperforina tem mostrado inibir a absorção dos neurotransmissores serotonina, dopamina, noradrenalina, GABA e do glutamato.
Foi identificado como um ativador específico do canal iônico TRPC6 que está envolvido no processo neuronal. A ativação das causas TRPC6 e a entrada dos de ions de sódio e cálcio nas células neuronais que pode explicar a inibição da captação do neurotransmissor.
Hiperforina também pode ser o responsável pela indução das enzimas do citocromo P450, CYP3A4 e CYP2C9 pela ligação ao receptor Pregnane X (PXR). A estrutura da Hiperforina foi elucidada por um grupo de investigação do Instituto de Shemyakin Química Bio-orgânica (Academia de Ciências da URSS em Moscou) e publicada em 1975. Não existe nenhum trabalho publicado a respeito da síntese total da Hiperforina, apesar das varias tentativas dos grupos de investigação.
OBSERVAÇÃO IMPORTANTE
ERVA DE SÃO JOÃO
Erva de São João (Hypericum perforatum) tem sido amplamente alegado como sendo eficaz como um antidepressivo. O mecanismo de ação é desconhecido; e o ingrediente ativo, se houver algum, não foi determinado. Estudos com extratos padronizados da hipericina (um dos constituintes da erva) descobriram que ela é cerca de duas vezes mais eficaz que o placebo. Alguns estudos demonstram que ela é um pouco mais eficaz que um antidepressivo padrão. Entretanto, nenhum destes estudos durou mais que seis semanas, o que não é longo o suficiente para determinar por quanto tempo a erva seria eficaz para detectar quaisquer efeitos adversos em longo prazo.
Além disso, alguns dos estudos não foram bem conduzidos. Na maioria destes estudos, o diagnóstico não foi bem estabelecido, a taxa de resposta ao placebo foi menor do que normalmente vista em estudos deste tipo, a dosagem do antidepressivo padrão foi baixa, e a dosagem da hipericina variou mais de seis vezes.
Nenhum efeito colateral grave foi relatado, mas efeitos colaterais menores incluindo desconforto gastrintestinal, fadiga, boca seca, vertigens, erupção cutânea e hipersensibilidade à luz solar. Entretanto, em fevereiro de 2000, a revista britânica Lancet publicou relatos de que a erva de São João pode interferir com a eficácia de um medicamento para a AIDS (Inidavir); uma droga imunossupressora (ciclosporina) usada para proteger pacientes após transplante cardíaco; e um anticoagulante (warfarin). Baseado neste estudo e outros relatos da literatura médica, a FDA emitiu um Conselho de Saúde Pública declarando OBSERVAÇÃO IMPORTANTE
ERVA DE SÃO JOÃO
Erva de São João (Hypericum perforatum) tem sido amplamente alegado como sendo eficaz como um antidepressivo. O mecanismo de ação é desconhecido; e o ingrediente ativo, se houver algum, não foi determinado. Estudos com extratos padronizados da hipericina (um dos constituintes da erva) descobriram que ela é cerca de duas vezes mais eficaz que o placebo. Alguns estudos demonstram que ela é um pouco mais eficaz que um antidepressivo padrão. Entretanto, nenhum destes estudos durou mais que seis semanas, o que não é longo o suficiente para determinar por quanto tempo a erva seria eficaz para detectar quaisquer efeitos adversos em longo prazo.
Além disso, alguns dos estudos não foram bem conduzidos. Na maioria destes estudos, o diagnóstico não foi bem estabelecido, a taxa de resposta ao placebo foi menor do que normalmente vista em estudos deste tipo, a dosagem do antidepressivo padrão foi baixa, e a dosagem da hipericina variou mais de seis vezes.
Nenhum efeito colateral grave foi relatado, mas efeitos colaterais menores incluindo desconforto gastrintestinal, fadiga, boca seca, vertigens, erupção cutânea e hipersensibilidade à luz solar. Entretanto, em fevereiro de 2000, a revista britânica Lancet publicou relatos de que a erva de São João pode interferir com a eficácia de um medicamento para a AIDS (Inidavir); uma droga imunossupressora (ciclosporina) usada para proteger pacientes após transplante cardíaco; e um anticoagulante (warfarin). Baseado neste estudo e outros relatos da literatura médica, a FDA emitiu um Conselho de Saúde Pública declarando que a erva de São João parece ser uma indutora de um importante mecanismo metabólico, o citocromo P450.
Como muitas drogas de prescrição usadas para tratar condições como doenças cardíacas, depressão, vertigem, certos tipos de cânceres ou prevenir condições como rejeição a transplante ou gravidez (contraceptivos orais) é metabolizada via este mecanismo, prestadores de assistência à saúde devem alertar com os pacientes sobre estes potenciais interações medicamentosas para prevenir perda do efeito terapêutico de qualquer droga metabolizada via citocromo P450.
A erva de São João não deveria ser usado por mulheres que estejam grávidas ou amamentando. Nem deveria ser usada junto com antidepressivo padrão. A potência e pureza das preparações vendidas nos Estados Unidos são desconhecidas.
BIBLIOGRAFIA
Alı Kemal Ayan; Cuneyt Cirak. 2008. Variation of hypericins in Hypericum triquetrifolium Turra growing in different locations of Turkey during plant growth Natural Product Research. 22 (18): 1597 – 1604. Bertilsson, G., Heidrich, H., Svensson, K. 2001. Identification of a human nuclear receptor defines a new signaling pathway for CYP3A4 induction. The Proceedings of the National Academy of Sciences. 95(1): 208-214.
Bilia, A.R., Gallori, S., Vincieri, F.F. 2002. St. John’s wort and depression efficacy, safety and tolerability-an update. Life Science. 70: 3077-3096.
Bystrov NS, Chernov BK, Dobrynin VN, Kolosov MN. 1975. "The structure of Hiperforin". Tetrahedron Letters 16 (32): 2791-2794.
C.A. Thomas, S. Tyagi, N. Yoshimura, M.B. Chancellor, P. Tyagi. 2007. MP-12.06: Effect of Hiperforina enriched extract on pro-ejaculatory effect of 8-OH-DPAT in anesthetized rats. Urology. 70 (3), Supplement 1. 103.
Calapai G, Crupi A, Firenzuoli F, Inferrera G, Squadrito F, Parisi A, De Sarro G, Caputi A. 2001b. Serotonin, norepinephrine and dopamine involvement in the antidepressant action of hypericum perforatum. Pharmacopsychiatry 34: 45–49.
Catherine A. Thomas, Shachi Tyagi, Naoki Yoshimura, Michael B. Chancellor, Pradeep Tyagi. 2007. Effect of Hiperforina-Enriched Extract on Pro-Ejaculatory Effect of 8-Hydroxy-2-(Di-N-Propylamino) Tetralin in Anesthetized Rats. Urology. 70 (4): 813-816.
Chatterjee SS, Bhattacharya SK, Wonnemann M, Singer A, Müller WE. 1998. "Hiperforina as a possible antidepressant component of hypericum extracts". Life Scence. 63 (6): 499–510.
De Smet PAGM, Nolen WA. 1996. St. John's wort as an antidepressant: Longer term studies are needed before it can be recommended in major depression. British Medical Journal 313: 241-242.
Evangelos C. Tatsis, Sjef Boeren, Vassiliki Exarchou, Anastassios N. Troganis, Jacques Vervoort, Ioannis P. Gerothanassis. 2007. Identification of the major constituents of Hypericum perforatum by LC/SPE/NMR and/or LC/MS. Phytochemistry. 68 (3): 383-393.
Gail B. Mahady, Yue Huang, Brian J. Doyle, Tracie Locklear. 2008. Natural products as antibacterial agents. Studies in Natural Products Chemistry. 35: 423-444.
Gaster B, Holroyd J. 2000. St. John's wort in depression. Archives of Internal Medicine 160:152-156.
Gaster, B.; Holroyd, J, H. 2000. St John’s Wort for depression: a systematic review. Archives of Internal Medicine. 160: 152-156.
Gunter P. Eckert, Jan-Henning Keller, Claudia Jourdan, Michael Karas, Dietrich A. Volmer, Manfred Schubert-Zsilavecz, Walter E. Müller. 2004. Hiperforina modifies neuronal membrane properties in vivo. Neuroscience Letters. 367 (2): 139-143.
Jin-Zhang Zeng, De-Fu Sun, Li Wang, Xihua Cao, Jian-Bin Qi, Ting Yang, Chang-Qi Hu, Wen Liu and Xiao-Kun Zhang. 2006. Hypericum sampsonii induces apoptosis and nuclear export of retinoid X receptor-alpha. Carcinogenesis 27(10): 1991–2000.
Jobst KA. 2000. Safety of St John's wort. Lancet 355: 576.
K. Treiber, A. Singer, B. Henke, W.E. Müller. 2005. P.1.11 Hiperforina inhibits serotonin uptake by activating non selective cation channels. European Neuropsychopharmacology. 15(1): S11-S12.
K. Treiber, A. Singer, B. Henke, W.E. Müller. 2006. TRP channel activation via tyrosine kinases as a novel antidepressant mechanism of action — studies with Hiperforina. European Neuropsychopharmacology. 16 (1): Page S18.
Katja Karppinen, Anja Hohtola. 2008. Molecular cloning and tissue-specific expression of two cDNAs encoding polyketide synthases from Hypericum perforatum. Journal of Plant Physiology. 165 (10): 1079-1086.
Kimberly D.P. Hammer, Matthew L. Hillwig, Jeffrey D. Neighbors, Young-Je Sim, Marian L. Kohut, David F. Wiemer, Eve S. Wurtele, Diane F. Birt. 2008. Pseudohypericin is necessary for the light-activated inhibition of prostaglandin E2 pathways by a 4 component system mimicking a Hypericum perforatum fraction. Phytochemistry. 69 (12): 2354-2362.
Leuner K, Kazanski V, Müller M. 2007. "Hiperforina-a key constituent of St. John's wort specifically activates TRPC6 channels". FASEB. 21 (14): 4101–4111.
Linda B. Moore, Bryan Goodwin, Stacey A. Jones, G. Bruce Wisely, Cosette J. Serabjit-Singh, Timothy M. Willson, Jon L. Collins, and Steven A. Kliewer. 2000. St. John's wort induces hepatic drug metabolism through activation of the pregnane X receptor. PNAS 97 (13): 7500-7502.
Linde K. 1996. St. John's wort for depression -- an overview and meta-analysis of randomised clinical trials. British Medical Journal 313: 253-258.
Ludger Beerhues. 2006. Hiperforina. Phytochemistry. 67 (20): 2201-2207.
Luiz G. Guilhermina, Luciana Ortiz, Maristela Ferigolo, Helena M.T. Barros. 2003. Commercially available Hypericum perforatum extracts do not drecrease immobility of rats in the forced swimming test. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 28 (1): 49-55.
Lumpkin MM, Alpert S. Risk of drug interactions with St. John's wort and indinavir and other drugs. FDA Health Advisory, Feb 10, 2000.
Marta Menegazzi, Michela Novelli, Pascale Beffy, Valentina D’Aleo, Elisa Tedeschi, Roberto Lupi, Elisa Zoratti, Piero Marchetti, Hisanori Suzuki, Pellegrino Masiello. 2008. Protective effects of St. John's wort extract and its component Hiperforina against cytokine-induced cytotoxicity in a pancreatic β-cell line. The International Journal of Biochemistry & Cell Biology. 40 (8): 1509-1521.
Miguel A. Medina, Beatriz Martínez-Poveda, María I. Amores-Sánchez, Ana R. Quesada. 2006. Hiperforina: More than an antidepressant bioactive compound? Life Sciences. 79 (2): 105-111.
Monmaney T. Labels' potency claims often inaccurate, analysis finds. Spot check of products finds widely varying levels of key ingredient. But some firms object to testing method and defend their brands' quality. Los Angeles Times, Aug 31, 1998.
Moore L.B., Goodwin, B., Jones, S.A., Wisely, G.B., Serabjit-Singh, C.J., Willson, T.M., Collins, J.L., Kliewer, S.A. 2000. St. John’s wort induces hepatic drug metabolism through activation of the pregnane X receptor. The Proceedings of the National Academy of Sciences. 97: 7.500-7.502.
Murphy, P.A. 2002. St John’s wort and oral contraceptives: reasons for concern? Journal of Midwifery & Women's Health. 47: 447-450.
Obach, R.S. 2000. Inhibition of human cytochrome P450 enzymes by constituents of St John’s wort, an herbal preparation used in the treatment of depression. The Journal of Pharmacology and Experimental Therapeutics. 294: 88-95.
Piscitelli SC. 2000. Indinavir concentrations and St John's wort. Lancet 355: 547.
Raffaele Capasso, Francesca Borrelli, Vittorino Montanaro, Vincenzo Altieri, Francesco Capasso, Angelo A. Izzo. 2005. Effects of the Antidepressant St. John′S Wort (Hypericum perforatum) on Rat and Human Vas Deferens Contractility. The Journal of Urology. 173 (6): 2194-2197.
Roots, I., Johne, A., Schmider, J., Brockmöller, J., Maurer, A., Stömer, E., Donath, F. 2000. Interactions of herbal extract from St Jonh’s wort with amitriptyline and its metabolites. Clinical Pharmacology & Therapeutics. 67: 159.
Ruschitzka F. 2000. Acute heart transplant rejection due to Saint John's wort. Lancet 355: 548.
Schwarz, U.I., Büschel, B., Kirch, W. 2003. Unwanted pregnancy on self-medication with St. John's wort despite hormonal contraception. British Journal of clinical Pharmacology. 55:112-113.
St. John's wort study launched. Complementary and Alternative Medicine at the NIH 4(4):5, October 1997.
Stevinson, C., Ernst, E. 1999. Hypericum extract for depression: an update for the clinical evidence. European Neuropsychopharmacology. 9: 501-505.
A. Szegedi, R Kohnen, A Dienel, M Kieser. 2005. Acute treatment of moderate to severe depression with hypericum extract WS 5570 (St John’s wort): randomised controlled double blind non-inferiority trial versus paroxetina. British Medical Journal. 330(7):503-506.
Thomas CA, Tyagi S, Yoshimura N, Chancellor MB, Tyagi P. 2007. "Effect of Hiperforina-enriched extract on pro-ejaculatory effect of 8-hydroxy-2-(di-N-propylamino) tetralin in anesthetized rats". Urology. 70 (4): 813–816.
Tiziana Mennini, Marco Gobbi. 2004. The antidepressant mechanism of Hypericum perforatum. Life Sciences. 75 (9): 1021-1027.
Walter E. Müller. 2003. Current St. John’s wort research from mode of action to clinical efficacy. Pharmacological Research. 47 (2): 101-109.
Yadhu N. Singh. 2005. Potential for interaction of kava and St. John's wort with drugs. Journal of Ethnopharmacology. 100 (1-2): 108-113.
Yue, QY, Bergquist, C, Gerden B. 2000. Safety of St John’s wort (Hypericum perforatum). Lancet. 355: 576-577.
_________________________
Kava Kava - kawa kawa
Piper methysticum G. Forst (Piperáceas)
Outros nomes: Ava, Intoxicating Pepper, Kava Kava, Kawa Kawa, Kew, Sakau, Tonga, Yangona
Utilizações legais:
Na os EUA o kava é vendida como suplementos dietéticos promovidos como alternativas naturais para drogas ansiolíticas e como pílulas para dormir. Uma meta-análise de seis randomizado, controlado com placebo, em dupla ocultação de ensaios clínicos constatou que kava kava (60-200 mg/dia de kavalactones) produziu uma redução significativa da ansiedade, em comparação com placebo. No entanto, o FDA não tenha decidido sobre a capacidade dos suplementos alimentares contendo kava para fornecer tais benefícios.
USO ILÍCITO
Informações sobre a utilização ilícita de kava nos EUA é anedótico. Com base em informações obtidas na Internet, está a ser utilizado “kava lazer” para relaxar o corpo e atingir uma leve euforia. É normalmente consumido como bebida feita a partir do pó seco da raiz, com aromas e extratos em pó, líquido e extrato dissolvido em álcool puro grãos e vegetais.
Os indivíduos podem consumir 25 gramas de kavalactones, que é de cerca de 130 vezes a dose diária em kava suplementos dietéticos. Indivíduos intoxicados normalmente têm processos de pensamento sensato e abrangentes conversas, mas têm dificuldade em coordenar movimentos e muitas vezes adormecer.
Os usuários do Kava não exibem o delírio e confusão generalizada quando ocorre com altos níveis de intoxicação alcoólica. No entanto, enquanto kava sozinho não produz alterações motores e cognitivos como o álcool. O kava não potenciou o efeito produzido pelo álcool sozinho.
O Kawa-Kawa (Piper methysticum) é uma planta da família Piperácea. Trata-se de um arbusto encontrado na Malásia e nas ilhas da Polinésia, que tem sido usada há mais de 3 mil anos pelos nativos das ilhas Fiji, Samoa e Tonga, no tratamento de doenças e também em cerimônias religiosas, por causa das propriedades sedativas e relaxantes.
Durante o ritual, os nativos usam o Kawa Kawa como bebida, e acredita-se no efeito relaxante da planta, combinado com outros elementos do ritual foi interpretado como uma espécie de transe. Nos últimos anos, o Kawa Kawa tem sido destacado como uma planta de grande utilidade no tratamento de problemas como a ansiedade nervosa, estados de tensão, agitação, ansiedade e insônia.
Estudos Farmacológicos mostram que os ingredientes ativos do Kawa Kawa - as kavalactonas - promovem um efeito relaxante nos músculos, particularmente útil em situações de estresse.
O Kawa Kawa logo ganhou fama como um poderoso ansiolítico natural. Atualmente, a planta tem sido testada para que seus efeitos sejam comparados com os tradicionais benzodiazepínicos (como Valium®, Lexotan®, Diazepam, etc.). No controle da ansiedade, com resultados favoráveis para o Kawa Kawa, porque ela não apresenta os efeitos colaterais comuns aos benzodiazepínicos, como a sonolência e a função mental reduzida. Partes da planta utilizada na preparação deste remédio são as folhas secas e rizomas, transformadas em pó.
Embora o efeito da Kawa Kawa esteja sendo comprovado cientificamente, atendendo ao seu uso somente sob supervisão médica, pois a planta apresenta contra-indicações. Seu uso não é recomendado durante a gestação, lactação e em casos de Parkinson, por exemplo. Além disso, como qualquer ansiolítico, sua dosagem deve ser controlada
A. Capasso, L. Sorrentino. 2005. Pharmacological studies on the sedative and hypnotic effect of Kava kava and Passiflora extracts combination. Phytomedicine. 12 (1-2): 39-45.
André Rex, Eve Morgenstern, Heidrun Fink. 2002. Anxiolytic-like effects of Kava-Kava in the elevated plus maze test—a comparison with diazepam. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 26 (5): 855-860.
Angelo Cagnacci, Serenella Arangino, Antonietta Renzi, Anna Lisa Zanni, Stefania Malmusi, Annibale Volpe. 2003. Kava–Kava administration reduces anxiety in perimenopausal women. Maturitas. 44 (2): 103-109.
Anna Rita Bilia, Sandra Gallori, Franco F. Vincieri. 2002. Kava-kava and anxiety: Growing knowledge about the efficacy and safety. Life Sciences. 70 (22): 2581-2597.
Baum SS, Hill R, Rommelspacher H. 1998. "Effect of kava extract and individual kavapyrones on neurotransmitter levels in the nucleus accumbens of rats". Progress in Neuro-Psychopharmacology and Biological Psychiatry. 22 (7): 1105–20.
Cairney, S. 2003. Saccade and cognitive function in chronic kava users. Neuropsychopharmacology 28 (2): 389–396.
Carmen Andreescu, Benoit H. Mulsant, James E. Emanuel. 2008. Complementary and alternative medicine in the treatment of bipolar disorder — A review of the evidence. Journal of Affective Disorders. 110 (1-2): 16-26.
Clough AR, Bailie RS, Currie B. 2003. Liver function test abnormalities in users of aqueous kava extracts. Journal of Toxicology Clinical Toxicology. 41 (6): 821–829.
Cord Backhau and Josef Krieglstein. 1992. Extract of Kava (Piper methysticin) and its methysticin constituents protect brain tissue against ischemic damage in rodents. European Journal of Pharmacology. 215: 265-269.
Cynthia S. Côté, Christine Kor, Jon Cohen, Karine Auclair. 2004. Composition and biological activity of traditional and commercial kava extracts. Biochemical and Biophysical Research Communications. 322 (1): 10147-10152.
Dallas L. Clouatre. 2004. Kava kava: examining new reports of toxicity. Toxicology Letters. 150 (1): 85-96.
Dominguez Jimenez JL; Pleguezuelo Navarro M; Guiote Malpartida S; Fraga Rivas E; Montero Alvarez JL; Poyato Gonzalez A. 2007. Hepatotoxicity associated with Hypericum (St. John's wort). Gastroenterol Hepatol. 30(1): 54-55.
E. A. Carlini. 2003. Plants and the central nervous system. Pharmacology Biochemistry and Behavior. 75 (3): 501-512.
E. Ernst. 2006. Herbal remedies for anxiety – a systematic review of controlled clinical trials. Phytomedicine. 13 (3): 205-208.
F. Stickel, H. M. Baumueller, K. H. Seitz, D. Vasilakis, G. Seitz, E. G. Hahn, H. K. Seitz and D. Schuppan. 2003. Kava-induced acute liver injury: A report of 29 novel cases. Journal of Hepatology. 38 (2): 217-218.
F. Stickeland and D. Schuppan. 2007. Herbal medicine in the treatment of liver diseases. Digestive and Liver Disease. 39 (4): 293-304.
Felix Stickel, Hans-Martin Baumüller, Karlheinz Seitz, Dimitrios Vasilakis, Gerhard Seitz, Helmut K. Seitz, Detlef Schuppan. 2003. Hepatitis induced by Kava (Piper methysticum rhizoma). Journal of Hepatology, 39 (1): 62-67.
H. Barton Grossman. 2006. Is adjuvant chemotherapy for bladder cancer safer in patients with an ileal conduit than a neobladder? Manoharan M, Reyes MA, Kava BR, Singal R, Kim SS, Soloway, MS, Department of Urology, University of Miami School of Medicine, Miami, FL. Urologic Oncology: Seminars and Original Investigations, 24 (3): 272.
H. Wong. 2003. Potential hepatotoxicity from complementary and alternative medicine (CAM)/dietary supplements (DS) containing comfrey, chaparral, and Kava Kava. Journal of Allergy and Clinical Immunology. 111 (1): Suppl 2, S167.
Holstege CP; Mitchell K; Barlotta K; Furbee RB. 2005. Toxicity and drug interactions associated with herbal products: ephedra and St. John's Wort. Medical Clinics of North America. 89(6): 1225-1257.
Hu, A. 2005. "Determination of six kavalactones in dietary supplements and selected functional foods containing Piper methysticum by isocratic liquid chromatography with internal standard". Journal of AOAC International. 88 (1): 16–25.
Hyla Cass. 2004. Herbs for the nervous system: Ginkgo, kava, valerian, passionflower. Seminars in Integrative Medicine. 2 (2): 82-88.
J. Anke, S. Fu and I. Ramzan. 2006. Kavalactones fail to inhibit alcohol dehydrogenase in vitro. Phytomedicine. 13 (3): 192-195.
J. Le Bot, S. Adamowicz 1, P. Robin. 1997. Modelling plant nutrition of horticultural crops: a review. Scientia Horticulturae 74: 47–82
Jioji N Tabudravu1, Marcel Jaspars. 2005. Anticancer activities of constituents of kava (Piper methysticum) The South Pacific. Journal of Natural Science. 23: 26-29.
Johannes Schulze, Walter Raasch, Claus-Peter Siegers. 2003. Toxicity of kava pyrones, drug safety and precautions – a case study. Phytomedicine. 10 (4): 68-73.
Juan Perez and James F. Holmes. 2005. Altered mental status and ataxia secondary to acute Kava ingestion. Journal of Emergency Medicine. 28 (1): 49-51.
Kapusta M; Dusek J. 2003. Therapeutic and toxicologic aspects of biological effects of Saint John's wort (Hypericum perforatum L.). Ceská a Slovenská Farmaice. 52(1): 20-28.
Klohs, M. W., Keller, F., Williams, R. E., Toekes, M. I. and Cronheim, G. E. 1959. A chemical and pharmacological investigation of Piper methysticum, Forster. Journal of Medicinal and Pharmacological Chemistry 1: 95-103.
L. Sorrentino, A. Capasso and M. Schmidt. 2006. Safety of ethanolic kava extract: Results of a study of chronic toxicity in rats. Phytomedicine. 13 (8): 542-549.
Lim ST, Dragull K, Tang CS, Bittenbender HC, Efird JT, Nerurkar PV 2007. "Effects of kava alkaloid, pipermethystine, and kavalactones on oxidative stress and cytochrome P450 in F-344 rats". Toxicological Sciences. 97 (1): 214–221.
Marcello Spinella. 2001. Herbal Medicines and Epilepsy: The Potential for Benefit and Adverse Effects. Epilepsy & Behavior. 2 (6): 524-532.
Moreno, Ricardo Alberto; Teng, Chei Tung; Almeida, Karla Mathias de; Tavares Junior, Hildeberto. 2006. Hypericum perforatum versus fluoxetine in the treatment of mild to moderate depression: a randomized double-blind trial in a Brazilian sample. Revista Brasileira de Psiquiatria. 28(1): 29-32.
Oliver Meissner, Hanns Häberlein. 2005. HPLC analysis of flavokavins and kavapyrones from Piper methysticum Forst. Journal of Chromatography B, 826 (1-2): 46-49.
Peter A. Whitton, Andrew Lau, Alicia Salisbury, Julie Whitehouse and Christine S. Evans. 2003. Kava lactones and the kava-kava controversy. Phytochemistry. 64 (3): 673-679.
Pilkington K; Boshnakova A; Richardson J. 2006. St John's wort for depression: time for a different perspective? Complementary Therapies in Medicine. 14(4): 268-281.
R. Teschke, W. Gaus, D. Loew. 2003. Kava extracts: Safety and risks including rare hepatotoxicity. Phytomedicine. 10 (5): 440-446.
Robert A. DiSilvestro, Wenyi Zhang and David J. DiSilvestro. 2007. Kava feeding in rats does not cause liver injury nor enhance galactosamine-induced hepatitis. Food and Chemical Toxicology. 45 (7): 1293-1300.
Robert Grace Mbbs, Fanzca, Fracp, Mmed. 2005. Kava-induced urticaria. Journal of the American Academy of Dermatology. 53 (5): 906.
S.Y. Mills, B. Steinhoff. 2003. Kava-kava: a lesson for the phytomedicine community. Phytomedicine. 10 (2-3): 261-262.
Saskia Lüde, Michael Török, Sandy Dieterle, René Jäggi, Karin Berger Büter and Stephan Krähenbühl. 2008. Hepatocellular toxicity of kava leaf and root extracts. Phytomedicine 15, (1-2): 120-131.
Seitz U, Schüle A, Gleitz J. 1997. [3H]-monoamine uptake inhibition properties of kava pyrones. Planta Medica. 63 (6): 548–549.
Shulgin, A. 1973. "The narcotic pepper - the chemistry and pharmacology of Piper methysticum and related species" Bulletin on narcotics. 25 (59): 59–74.
Siegfried Lehrl. 2004. Corrigendum to “Clinical efficacy of kava extract WS® 1490 in sleep disturbances associated with anxiety disorders. Results of a multicenter, randomized, placebo-controlled, double-blind clinical trial” Journal of Affective Disorders. 78: 101–110.
Sorrentino L, Capasso A, Schmidt M. 2006. Safety of ethanolic kava extract: Results of a study of chronic toxicity in rats. Phytomedicine 13 (8): 542–549.
Tran Dang Xuan, Ogushi Yuichi, Chikara Junko, Eiji Tsuzuki, Terao Hiroyuki, Matsuo Mitsuhiro, Tran Dang Khanh, Nguyen Huu Hong. 2003. Kava root (Piper methysticum L.) as a potential natural herbicide and fungicide. Crop Protection. 22 (6): 873-881.
Yadhu N. Singh. 2005. Potential for interaction of kava and St. John's wort with drugs. Journal of Ethnopharmacology. 100 (1-2): 108-113.
Yuzhong Ma, Karuna Sachdeva, Jirong Liu, Michael Ford, Dongfang Yang, Ikhlas A. Khan, Clinton O. Chichester, and Bingfang Yan. 2004. Desmethoxyyangonin and Dihydromethysticin are Two Major Pharmacological Kavalactones with Marked Activity on the Induction of Cyp3a23. Drug Metabolism and Disposition. 32 (11): 1317–1324.
__________________________
ECHINACEA
Echinacea purpurea (L) Moench (Asteraceae)
Família: Compositae (Daisy) - Asteraceae (aster)
Outros nomes comuns: Red Sunflower, Purple Coneflower, Black Sampson, Hedgehog, Coneflower, Snake Root, Sampson Root, Rudbeckia, Comb Flower, Indian Head.
Echinacea, comumente conhecida pelo seu nome popular em Inglês “Purple Coneflower”, é um gênero de nove espécies de plantas herbáceas da Família das Asteraceae. Ela é estritamente nativa da região leste e central da América do Norte. As plantas têm grandes, compostas de ostentação chefes de flores, florescimento. Algumas dessas espécies são utilizadas como remédio.
O gênero é a partir do nome grego echino, que significa "espinhoso", devido aos espinhos no disco central. Eles são herbáceas, planta perene, crescendo 1 ou 2 m de altura. As folhas são elípticas a lanceoladas, 10 - 20 cm de comprimento. Como todas as Asteraceae, as flores são umas compósitas inflorescências, com roxo (raramente amarelo ou branco) disposto em uma proeminência, algo em forma de cone de cabeça - "forma de cone", porque as pétalas de raios florets exteriorizam e tende para baixo, uma vez aberta, a flor com a cabeça em forma um cone.
HISTÓRIA
Echinacea purpurea é uma herbácea, planta perene que é nativa nas planícies do oeste americano e tem sido largamente cultivada na Europa, onde é pensado para ser talvez o mais poderoso antibiótico natural.
Os dois pés de plantas podem ser encontrados crescendo em pradarias secas e outros lugares abertos, florescente, com o solo bem drenado. Echinacea, o nome é derivado do grego, echinos, significando "ouriço" ou "ouriço do mar".
Existem três espécies deste gênero que incluem muitas das mesmas propriedades e aplicações (E. purpurea, E. angustifolia e E. pallida), e são frequentemente utilizados alternadamente. Nativos americanos utilizaram à roxa “coneflower” mais do que qualquer outra planta no tratamento de doenças e lesões, incluindo mordida de cobra, febre, feridas, queimaduras, infecções e dor de dente.
Com os primeiros colonos a Echinacea foi adaptada como um remédio para as constipações e gripe, e da erva-americana se tornou popular entre as plantas medicinais e a medicina tradicional.
A erva foi incluído no Formulário Nacional, do Livro dos Farmacêuticos de consulta, a partir de 1915, e depois em 1950, apesar da perda da Echinacea na América após a década de 1930, ela foi “redescoberta” na década de 80 do século passado, devido ao crescente interesse no Sistema Imunitário, Síndrome de fadiga crônica, câncer, candidíase, etc. Geralmente acreditavam que Echinacea purpurea é o mais potente dos três, e sendo mais facilmente cultivadas, também a mais usada.
E. purpurea também se pensa ser a mais eficaz como uma espécie desintoxicante e sistema imunológico detonadora, particularmente em situações respiratórias, e a Equinácea foi aprovada pelos praticantes Ayurveda.
Há agora muito interesse renovado dos Estados Unidos, por causa da erva e do efeito positivo sobre o sistema imunológico, e as ervas alcançaram fama mundial por sua ação antiviral, antifúngica e propriedades antibacterianas, estes dados basear-se em documentação científica recente.
Echinacea contém um antibiótico natural chamado echinacoside (um glicosídeo) e um composto chamado echinaceina (uma amida). Ambas as componentes neutralizar as enzimas produzidas por micróbios que atacam e invadem células tecidas saudáveis.
Outros componentes incluem ácidos graxos, óleos essenciais, quercetina, alcalóides, polissacarídeos, alkamides, frutanos, carboidratos, germacreno, humuleno, limoneno, myrcene, pineno alfa, beta-pineno, kaempferol, rutina, cafeico-, - clorogênicos, catárico e palmítico Ácido, terpenóides, vitamina B1, B2, B3 e vitamina C, ferro, cálcio, magnésio, manganês, fósforo, potássio, selénio, zinco, flavonóides, beta-caroteno e de outros nutrientes importantes.
EFEITO MEDICINAL
Pelo menos um estudo mostra que a Echinacea purpurea têm propriedades antidepressivas. Esta ficha fornece informações básicas sobre a erva. Inclui flores, folhas, cascas, frutos, sementes, caules e raízes. São nove espécies conhecidas de echinacea, sendo que todas são nativas do sul dos Estados Unidos e Canadá. O mais comumente usado, Echinacea purpurea, acredita-se ser o mais potente.
Pelo menos um estudo mostra Echinacea purpurea tem propriedades antidepressivas. Esta ficha fornece informações básicas sobre a erva. Uma planta ou parte de uma planta utilizada para o seu sabor, aroma, propriedades terapêutica ou potencial. Inclui flores, folhas, cascas, frutos, sementes, caules e raízes.
Efeitos colaterais e advertências
Poucos efeitos colaterais de echinacea são relatados quando ele é usado nas doses recomendadas. Queixas relatadas incluem desconforto gástrico, náuseas, dor de garganta, erupção cutânea (alérgicas, urticária, ou nódulos dolorosos chamados "eritema nodoso"), sonolência, dores de cabeça, tonturas e dores musculares.
Raros casos de hepatite (inflamação hepática), insuficiência renal, cardíaca ou irregular (fibrilação atrial) têm sido relatadas em pessoas que tomam echinacea, embora não sejam claro que estas eram devidas a echinacea.
Injetada a echinacea pode alterar níveis de açúcar no sangue e causar reações graves e devem ser evitados. Echinacea tem sido associada a um aumento da incidência de exantema em crianças, e, portanto, os riscos da utilização maior superam os potenciais benefícios.
Púrpura trombocitopênica trombótica (TTP) também tem sido relatado. Alguns especialistas em medicina natural desencorajar o uso de echinacea por pessoas com condições que afetam o sistema imunitário, tais como o HIV/SIDA, alguns tipos de câncer, esclerose múltipla, tuberculose, e doenças reumatológica (tais como artrite reumatóide ou lupus).
No entanto, existe uma falta de relatórios ou estudos específicos nesta área, e os riscos do uso da echinacea com estas condições não estão claras. O uso em longo prazo desta erva pode causar baixa de glóbulos brancos (leucopenia).
Doentes com transplante hepático que consomem grandes quantidades de echinacea podem ter aumentado à atividade de enzimas hepáticas, que muitas vezes indicam dano hepático. Embora a relevância de tal não seja clara, doentes com transplante hepático, a echinacea deve ser usada com cautela devido a seus potenciais perigos*.
*O Autor não aconselha o uso desta planta em transplantados
Gravidez e Aleitamento Materno
Neste momento, echinacea não podem ser recomendados durante a gravidez ou amamentação. Embora estudos preliminares mostrem nenhum efeito sobre a gravidez, não há investigação aprofundada nesta área. As mulheres grávidas devem evitar tinturas devido ao alto potencial do teor alcoólico.
Com uma reputação como o melhor da natureza potencializador do sistema imunológico, Echinacea purpurea acredita-se ser um dos mais poderosos da natureza como antibiótico natural. Considerado o mais potente do gênero Echinacea, Echinacea purpurea ajuda a estimular as resistências do organismo a infecções, doenças, febre e septicemia.
UTILIZAÇÃO BENÉFICA
Echinacea purpurea obras: auxilia o sistema imunológico contra a ameaça de doenças e infecções. Há evidências de que ele pode simular a ação do interferon, uma substancia natural que é capaz de blindagem de células a partir de invasão viral. Considerado um antiviral e antibacteriano, Echinacea não só mata bactérias e vírus, mas também na realidade a imunidade é reforçada através do aumento do número de glóbulos brancos no sangue.
Segundo os investigadores alemães, a erva é dito para aumentar os níveis de infecção de combate a células T de trinta por cento, construindo assim resistência imunológica. E relatou que a Comissão demonstrou E. purpurea apresenta efeitos imunoestimulante de várias maneiras: O número de glóbulos brancos e células do baço estão aumentados, a capacidade de fagocitose por granulócitos humano é ativado, e se elevou à temperatura corporal.
O chá é hoje considerado um dos mais eficazes desitoxicantes na medicina popular ocidental contra problemas: circulatório, respiratório e o sistema linfático, especialmente. E. purpurea, que é considerado mais potente do que outras espécies. É um excelente Tonico linfático, limpeza do sistema de materiais tóxicos, e pode ser particularmente útil nos casos de gânglios inchados e contra hipertrofia da próstata.
Um maior apoio do papel da Echinacea como um depurativo, ou agente que tende a limpar e purificar o sangue pelo assassinato contaminante no sangue, a erva acredita-se ser eficaz no tratamento do envenenamento do sangue e septicemia.
O chá também a partir do estômago ajuda a expulsar venenos, toxinas, pus e formações de abscessos no corpo. Além disso, como um agente de produção de suor. Referido como um antifúngico, Echinacea purpurea é dito para ser eficaz contra infecções vaginal de levedura, como a Cândida, e de outras infecções fúngicas.
Echinacea purpurea está sendo investigada por sua possível propriedades anticancerígena indireta, através dos seus efeitos de reforço imunológico geral. A estimulação da erva de polissacarídeos e fitoesteróis são particularmente importantes, porque são os ingredientes que aparecem para ativar macrófagos, os agentes que engolir e digerir células tumor ais e destruir bactérias, vírus e agentes infecciosos. De acordo com Loyola University Health System informação, algumas doenças malignas têm sido tratadas com Echinacea e junto com o efeito da quimioterapia pode ser melhorado.
Ao primeiro sinal de um resfriado, gripe, febre, dor de ouvido ou quando for necessária uma ação antibiótica, tomar Echinacea.
Diz-se contra a ameaça de infecções, ou pelo menos diminuir sua extensão e gravidade. Para a prevenção e o tratamento de infecções do trato respiratório superior, E. purpurea acredita-se ser o mais potente das espécies de Echinacea para esta indicação e tem sido útil em casos de bronquite.
Echinacea é considerado um antibiótico e anti-séptico que tem uma reputação de combate qualquer tipo de infecção, bactérias, vírus e germes como nenhum outro e foi pensada para ser eficaz no tratamento da infecção urinária, infecção Staph, infecção nos rins, intoxicação alimentar, picadas venenosas (cobras e insetos), sífilis, difteria e outras febres pútridas. Na Alemanha, é utilizado para combater bronquite e abscessos.
Echinacea é chamado de um antiinflamatório e um eficaz agente que trabalha para reduzir a dor e o inchaço e combate as lesões de todos os tipos de inflamação, incluindo dor de garganta, amidalite e hemorróidas. Acredita-se que a Echinacea purpurea promover regeneração tecidual.
É considerada uma "alternativa", ou erva que gradualmente converte um órgão em condição insalubre para um órgão saudável e facilita gradualmente mudanças benéficas no organismo. Echinacea purpurea é dito para promover a boa digestão e ajudar a aliviar flatulência
Usado tanto interno como externamente. Os efeitos da Echinacea como uma cura para todos os tipos de problemas de pele e infecções são lendários, ajudando a aliviar cortes, o frio ferido, furúnculos, carbúnculos, acne, herpes e gangrena.
Uma das suas propriedades químicas, chamado echinaceina, não é só pensamento para repelir micróbios, mas também estimular a reparação de células da pele. Topicamente, tem sido utilizado para aliviar o sol na pele, eczema infectado ou chorando, intoxicação por planta (hera, etc.), lesões de herpes, feridas infectadas e outras doenças da pele.
** Fornecida benéfica em investigação propriamente dita que as pessoas envolvidas, subscrito pela Comissão da Alemanha para uso terapêutico, tais como: Dor, Bronquite, constipações, tosse, febre, gripe, HIV, sistema imunológico, Depressão, Infecções (Incluindo Listeria, Lyme Doença, Tricomoníase, e Tifo), Meningite, Inflamação da Boca, Papeira, faringite, problemas respiratórios, infecções do trato urinário, insuficiência glóbulos brancos (leucopenia) e feridos.
** Desde que as investigações não envolvem seres humanos.
BIBLIOGRAFIA
B. Barrett. 2003. Medicinal properties of Echinacea: A critical review. Phytomedicine. 10 (1): 66-86.
B. Dave Oomah, Delphine Dumon, Anaberta Cardador-Martínez, David V. Godfrey. 2006. Characteristics of Echinacea seed oil. Food Chemistry. 96 (2): 304-312.
Barrett BP, Brown RL, Locken K. 2002. Treatment of the common cold with unrefined echinacea: a randomized, Double-blind, placebo-controlled trial. Annals of Internal Medicine. 137(12): 939–946.
E. Schwarz, A. Parlesak, H.-H. Henneicke-von Zepelin, J.C. Bode, C. Bode. 2005. Effect of oral administration of freshly pressed juice of Echinacea purpurea on the number of various subpopulations of B- and T-lymphocytes in healthy volunteers: Results of a Double-blind, placebo-controlled cross-over study. Phytomedicine. 12 (9): 625-631.
Ferdinand Bohlmann, Horst Hoffmann. 1983. Further amides from Echinacea purpurea. Phytochemistry. 22 (5): 1173-1175.
Giulia Di Carlo, Immacolata Nuzzo, Raffaele Capasso, Maria Rosaria Sanges, Emilia Galdiero, Francesco Capasso, Caterina Romano Carratelli. 2003. Modulation of apoptosis in mice treated with Echinacea and St. John’s wort. Pharmacological Research. 48 (3): 273-277.
Kemp DE, Franco KN. 2002. Possible leukopenia associated with long-term use of echinacea. The Journal of the American Board of Family Medicine. 15(5): 417-419.
L.J. Clifford, M.G. Nair, J. Rana, D.L. Dewitt. 2002. Bioactivity of alkamides isolated from Echinacea purpurea (L.) Moench. Phytomedicine. 9 (3): 249-253.
Tanha Patel, Audra Crouch, Kayla Dowless, David Freier. 2008. 122 Acute effects of oral administration of a glycerol extract of Echinacea purpurea on peritoneal exudate cells in female swiss mice. Brain, Behavior, and Immunity. 22 (4), Supplement 1. Page 39.
Taylor JA, Weber W, Standish L. 2003. Efficacy and safety of echinacea in treating upper respiratory tract infections in children: a randomized controlled trial. Journal of the American Medical Association. 290 (21): 2824–2830.
V. A. Kurkin, A. V. Dubishchev, V. N. Ezhkov, I. N. Titova, and E. V. Avdeeva1. 2006. Antidepressant Activity of some phytopharmaceuticals and phenylpropanoids. Pharmaceutical Chemistry Journal. 40 (11): 33 – 38
________________________
MARACUJÁ
Passiflora incarnata e edulis (Passifloraceae).
O gênero Passiflora compreende cerca de 500 espécies, é o maior da Família das Passifloraceae (flor da Paixão). A espécie deste gênero está distribuída nas regiões tropicais e temperada quentes do Novo Mundo, pois ela é muito rara na Ásia, Austrália e África tropical.
Passiflora incarnata L., também conhecido como Maypop, Maracujá ou Paixão flor, é uma conhecida planta medicinal nativa da América nas áreas tropicais. Ela é utilizada para o tratamento da ansiedade, nervosismo e neuralgia, e foi recomendado no início do século, para insônia e para menopausa.
Efeito Ansiolítico e sedativo tem sido observado em roedores. Passiflora edulis tem uma grande propagação de plantas cultivadas em torno de todos os países tropicais do mundo. No Brasil, os frutos são comumente conhecidos como "Maracujá" com polpa de frutas e um delicioso suco de rendimentos, que é exportada para vários países. Durante a produção industrial do "suco de Maracujá".
HISTÓRIA
O uso de Passiflora como um remédio foi louvado pela primeira vez por um investigador espanhol de nome Monardus no Peru em 1569 como as belas flores de Passiflora apareceram-lhe para ser o símbolo da Paixão de Cristo. Várias espécies de Passiflora têm sido amplamente utilizadas na terapêutica tradicional em muitos países.
INDICAÇÃO POPULAR
Passiflora incarnata é um remédio popular tradicional na Europa, bem como um medicamento homeopático para insônia, ansiedade, e tem sido usado como um chá sedativo na América do Norte.
A planta tem sido usada como analgésico, antiespasmódico, antiasmático, e sedativos no Brasil, como sedativo e de estupefacientes no Iraque; doente em condições similares de dismenorréia, epilepsia, insônia, neurose e nevralgias, na Turquia; para curar a histeria e a neurastenia na Polônia, na diarréia, dismenorréia, nevralgias, queimaduras, hemorróidas e insônia na América.
EFEITO FARMACOLÓGICO
Passiflora incarnata
Maltol, um derivativado y-benzopirona, e etílico maltol foram avaliados por seus efeitos depressores-SNC. Foi relatado que o Maltol e o Maltol etílico potencialisa o sono induzida-hexobarbital, inibe as convulsões induzidas pelo pentilenetetrazol por anfetamina também diminuiu hiperatividade em ratos.
Maltol Etílico foi relatado por um potente anti-convulsivante do que maltol, mas comparativamente menos potente na diminuição da atividade espontânea motora.
Passiflora edulis
Extrato aquoso de Passiflora edulis tem sido relatado por não apresentar efeitos depressores do SNC específicos em camundongos, ratos e humanos voluntários saudáveis. “Foi também sublinhado que algumas amostras de Passiflora edulis não tiveram um efeito sedativo específico” SNC.
O uso tradicional atribuido as propriedades sedativas do maracujá, ansiolíticas e antiespasmódicas, são parcialmente confirmados por experiência em animais.
TOXICOLOGY
• Embora remédios à base de plantas sejam geralmente considerados seguros, no entanto, a FDA dos Estados Unidos têm relatado 15 casos ocorridos de toxicidade devido ao consumo de multi-ingrediente.
• Passiflora edulis demonstrou toxicidade hepatobiliar e pancreática em animais e em seres humanos. Por outro lado, a Passiflora incarnata é listada como "segura como sedativo" pelo FDA dos U.S.A. A passoflora é considerada com um efeito muito, foi aconselhado fazer uso da Passiflora incarnata com precaução quando tomado juntamente com outros estimulantes ou depressoras do SNC.
• A revista popular americana E.U. “O Farmacêutico” desencorajou o uso de Passiflora incarnato em mães lactantes (E.U. O Farmacêutico, 2001). Devido à presença do alcalóido passiflorine e harmina, a planta é relatada como uma erva em geral tóxico pela Universidade da Califórnia em seu Boletim Informativo “Ambiental Toxicológico”.
• Os efeitos nocivos do alcalóide harmala presente na Passiflora incarnata foram contabilizados e o seu efeito colateral em longo prazo da prescrição do alcalóide foi estritamente proibido na Austrália.
NOTA
O maracujá roxo escuro (por exemplo, no Quênia) é menor do que um limão, enrugada courato na maturidade. A variedade roxa da fruta se tem informação da presença de vestígios de glicósidos cianogênicas e, portanto, são levemente venenosas.
AVALIAÇÃO
De acordo com o trabalho de Kamaldeep Dhawan et al (2001) a correta identidade de Passiflora incarnata e Passiflora edulis foi recentemente criada usando vários parâmetros. Para reforçar estas conclusões, a atividade ansiolítica destas duas plantas é controversa, e têm sido amplamente investigadas.
O extrato metanólico de Passiflora incarnata apresentou significativa atividade ansiolítica em uma dose oral de 125 mg/kg, enquanto que Passiflora edulis foi desprovida de qualquer atividade significativa.
BIBLIOGRAFIA
A. J. Vargas, D.S. Geremias, G. Provensi, P.E. Fornari, F.H. Reginatto, G. Gosmann, E.P. Schenkel, T.S. Fröde. 2007. Passiflora alata and Passiflora edulis spray-dried aqueous extracts inhibit inflammation in mouse model of pleurisy. Fitoterapia. 78 (2): 112-119.
Ana Beatriz Montanher, Silvana Maria Zucolotto, Eloir Paulo Schenkel, Tânia Silvia Fröde. 2007. Evidence of anti-inflammatory effects of Passiflora edulis in an inflammation model. Journal of Ethnopharmacology. 109 (2): 281-288.
Aoyagi, N., Kimura, R., Murata, T., 1974. Passiflora incarnata dry extract. I. Isolation of maltol and pharmacological action of maltol and ethyl maltol. Chemical and Pharmaceutical Bulletin. 22: 1008–1013.
E. Speroni and Minghetti. 1988. Neuropharmacological activity of extracts from Passiflora Incarnata. Planta Medica. 54(6): 488-491.
Eliana Rodrigues, Ricardo Tabach, José Carlos F Galduróz, Giuseppina Negri. 2008. Plants with possible anxiolytic and/or hypnotic effects indicated by three Brazilian cultures — Indians, Afro-Brazilians, and river-dwellers. Studies in Natural Products Chemistry. 35: 549-595.
Fabiana Antognoni, Suiping Zheng, Cristina Pagnucco, Rita Baraldi, Ferruccio Poli, Stefania Biondi. 2007. Induction of flavonoid production by UV-B radiation in Passiflora quadrangularis callus cultures. Fitoterapia. 78 (5): 345-352.
H.R. Chaudhry, R. Taj, N. Saeed, N.H. Khan, A. Chaudary, A.J.M. Loonen. 2007. P.2.g.006 Effectiveness of a combination of Hypericum and Passiflora for the treatment of depression with concomitant anxiety. European Neuropsychopharmacology. 17 (4): S394.
J.T. Doyama, H.G. Rodrigues, E.L.B. Novelli, E. Cereda, W. Vilegas, 2005. Chemical investigation and effects of the tea of Passiflora alata on biochemical parameters in rats. Journal of Ethnopharmacology. 96: 371-374.
Jucélia Pizzetti Benincá, Ana Beatriz Montanher, Silvana Maria Zucolotto, Eloir Paulo Schenkel, Tania Silvia Fröde. 2007. Evaluation of the anti-inflammatory efficacy of Passiflora edulis. Food Chemistry. 104 (3): 1097-1105.
Judith Jiménez, Leticia Riverón-Negrete, Fikrat Abdullaev, Javier Espinosa-Aguirre, Rosario Rodríguez-Arnaiz. 2008. Cytotoxicity of the β-carboline alkaloids harmine and harmaline in human cell assays in vitro. Experimental and Toxicologic Pathology. 60 (4-5): 381-389.
Kacem Rharrabe, Ahmed Bakrim, Naima Ghailani, Fouad Sayah. 2007. Bioinsecticidal effect of harmaline on Plodia interpunctella development (Lepidoptera: Pyralidae) Pesticide. Biochemistry and Physiology. 89 (2): 137-145.
Kamaldeep Dhawan, Sanju Dhawan, Anupam Sharma, 2004. Passiflora: Reviews update. Journal of Ethnopharmacology. 94: 1-23.
Kamaldeep Dhawan, Suresh Kumar and Anupam Sharma. 2001. Comparative biological activity study on Passiflora incarnata and Passiflora edulis. Fitoterapia. 72 (6): 698-702.
Kamaldeep Dhawan, Suresh Kumar, Anupam Sharma, 2001. Anti-anxiety studies on extracts of Passiflora incarnata Linneaus. Journal of Ethnopharmacology 78: 165-170.
Kamaldeep Dhawan, Suresh Kumar, Anupam Sharma., 2001. Anxiolytic activity of aerial and underground parts of Passiflora incarnate. Fitoterapia. 72: 922-926.
Luiz F. Lolli, Cláudia M. Sato, Cássia V. Romanini, Larissa De Biaggi Villas-Boas, Cid A. Moraes Santos, Rúbia M.W. de Oliveira. 2007. Possible involvement of GABAA-benzodiazepine receptor in the anxiolytic-like effect induced by Passiflora actinia extracts in mice. Journal of Ethnopharmacology. 111 (2): 308-314.
M. Rudnicki, M.M. Silveira, T.V. Pereira, M.R. Oliveira, F.H. Reginatto, F. Dal-Pizzol, J.C.F. Moreira. 2007. Protective effects of Passiflora alata extract pretreatment on carbon tetrachloride induced oxidative damage in rats. Food and Chemical Toxicology. 45 (4): 656-661.
Rachid Soulimani, Chafique Younos, Salah Jarmouni, Dalila Bousta, René Misslin and François Mortier. 1997. Behavioural affects of Passiflora incarnata L. and its indole alkaloid and flavonoid derivatives and maltol in the mouse. Journal of Ethnopharmacology. 57 (1): 11-20.
Shahin Akhondzadeh , MR Mohammadi & F Momeni. 2005. Passiflora incarnata in the treatment of attention-deficit hyperactivity disorder in children and adolescents. Therapy. 2(4): 609-614.
Thomas Stöhr, Delphine Lekieffre, Joachim Freitag. 2008. Lacosamide, the new anticonvulsant, effectively reduces harmaline-induced tremors in rats. European Journal of Pharmacology. 589 (1-3): 114-116.
______________________________
.
Transtorno distímico é uma forma crônica e incapacitante de depressão, ocorrendo em uma parcela substancial da população (3 a 6%) e aumentando os riscos de transtorno depressivo maior. Ela é associada a consideráveis incapacitações e elevada comorbidade. As depressões crônicas são geralmente de intensidade mais leve que os episódios de depressão maior. Mais que o humor francamente deprimido, os pacientes com depressão crônica (distimia) sofrem por não sentir prazer nas atividades habituais, e por terem suas vidas coartadas por uma espécie de morosidade irritável.
MELANCOLIA
Sigmund Freud, estudando o superego, identificou algo conhecido na época como melancolia. Para ele a melancolia se assemelhava ao luto, mas sem haver necessariamente uma perda Pessoas com sintomas de melancolia falam de si próprias como "inúteis", "incapazes de amar", "incapazes de fazer algo bem, ou de bom para os outros", como "irritantes", com "hábitos chatos", e outras características onde o eu interior é desvalorizado por afirmações muitas vezes falsas.
BIBLIOGRAFIA
MELANCOLIA
Sigmund Freud, estudando o superego, identificou algo conhecido na época como melancolia. Para ele a melancolia se assemelhava ao luto, mas sem haver necessariamente uma perda Pessoas com sintomas de melancolia falam de si próprias como "inúteis", "incapazes de amar", "incapazes de fazer algo bem, ou de bom para os outros", como "irritantes", com "hábitos chatos", e outras características onde o eu interior é desvalorizado por afirmações muitas vezes falsas.
BIBLIOGRAFIA
American Psychiatric Association. Diagnostic and Statiscal Manual of Mental Disorders. 4th ed. Washington, DC: American Psychiatric Association; 1994.
Benjamin James Sadok and Virginia Acott Sadok. Compêndio de Psiquiatria: ciência do comportamento e psiquiatria clínica. Ed. Artmed 9a edition.
Frederico G. Graeff. 2002. Review: On serotonin and experimental anxiety. Psychopharmacology. 163 (3-4): 1432-2072.
Gelder, Michael; Mayou, Richard; Cowen, Philip. Tratado De Psiquiatria. 4ª Edição. Guanabara koogan 2006. pp 834.
Harold I. Kaplan and Benjamim. Compendio de Psiquiatria: Ciências comportamentais - Psiquiatria Clínica. Editora Arte Médicas. Porto Alegre - Brasil. 1993. pp 955.
VALERIANA
É um produto obtido da raiz de uma planta muito difundida na Europa, a Valeriana officinalis. Foi o principal sedativo usado tanto na Europa como na América, antes da descoberta do barbitúrico, nos anos iniciais do século 20. Caracteristicamente possui um odor forte e desagradável. É sem dúvida um importante sedativo, podendo ser usado como indutor do sono. Pode ser utilizado ainda como calmante durante o dia, e como sedativo para crianças.
Ácido valerênico
o se conhece bem qual a sua substância ativa. É utilizado na forma de tintura. A dose recomendada como indutor de sono é de ±30 gotas de tintura, em água, ao deitar. Existe também em forma de cápsulas.
Como todo sedativo, tem ação depressora sobre o sistema nervoso, podendo provocar depressão. Não causa dependência, sendo menos potente do que os sedativos conhecidos. Pode aumentar a ação do álcool, não devendo ser associada ao mesmo.
O tratamento da ansiedade e dos problemas de sono deve ser observado outras formas terapêuticas que não a química ou a derivada de plantas. A tensão emocional responde muito bem a técnicas de relaxamento e a psicoterapia corporal, por exemplo. Os problemas de sono em geral são complexos e freqüentemente estão relacionados a graves problemas psicológicos como a depressão. Devemos sempre procurar orientação médica antes de utilizarmos medicamentos ou remédios. Antes de iniciarmos um tratamento devemos nos submeter à investigação profunda. Em geral há um medicamento ideal para cada pessoa, que deve ser utilizado em dose correta e sempre por um determinado tempo.
É muito comum em nosso meio a utilização de medicamentos sem orientação médica e por longo tempo. Muitas vezes ao se dirigir à consulta médica o paciente esquece-se de mencionar qual o produto que vem sendo utilizando. Um exemplo disto ocorre com laxantes naturais, muito utilizados e raramente citados. É interessante lembrar que inclusive o uso de pomadas deve ser mencionado.
Ao consultarmos um médico, ao iniciarmos um tratamento, ao realizarmos um procedimento cirúrgico, devemos informar sempre todos os medicamentos que estão sendo utilizados.
BIBIOGRAFIA
Adams P. 1998. "Drug interactions that matter. (1) Mechanisms and management." The Pharmaceutical Journal. 261: 618-621.
D'Arcy P. 1993. "Adverse reactions and interactions with herbal medicines. Part 2 - drug interactions." Adverse Drug Reactions and Toxicological Review. 12(3):147-162.
Ernst E. 2000. "Possible interactions between synthetic and herbal medicinal products. Part 1: A systematic review of the indirect evidence." Perfusion. 13: 4-15.
Featherstone C, Godden D, Gault C, Emslie M, Took-Zozaya M. 2003. Prevalence study of concurrent use of complementary and alternative medicine in patients attending primary care services in Scotland. American Journal of Public Health . 93(7):1080-1982.
Fugh-Berman A, Ernst E. 2001. "Herb-drug interactions: Review and assessment of report reliability." British Journal of Clinical Pharmacology. 52: 587-595.
K.A. Wesnes, T. Ward, A. McGinty and O. Petrini. 2000. The memory enhancing effects of a Ginkgo biloba/Panax ginseng combination in healthy middle-aged. Psychopharmacology. 152 (4): 353-361.
Lambrecht JE, Hamilton W, Rabinovich A. 2000. "A review of herb-drug interactions: Documented and theoretical." US Pharmacist: 25(8): 42-53.
T . Breidenbach , M . Hoffmann , T . Becker , H . Schlitt , J . Klempnauer. 2000. Drug interaction of St John's wort with ciclosporin. The Lancet , 355 (9218): 1912–1912.
Vladimir Vuksan, John L. Sievenpiper, Vernon Y. Y. Koo, Thomas Francis, Uljana Beljan-Zdravkovic, Zheng Xu, Edward Vidgen. 2000. American Ginseng (Panax quinquefolius L) Reduces Postprandial Glycemia in Nondiabetic Subjects and Subjects with Type 2 Diabetes Mellitus. Archives of Internal Medicine. 160: 1009-1013.
_________________________
ERVA DE SÃO JOÃO (ST. JOHN’S WORT)
Hypericum perforatum Guttiferae (Hiperricoidaea)
Erva de São João é amplamente distribuída na Europa, Ásia, África do Norte e foi aclimatado no U.S.A.
Durante séculos o Hypericum perforatum foi amplamente utilizada, inicialmente, por sua habilidade para curar feridas, úlceras na pele e queimaduras. Considerada capaz de afastar maus espíritos, também foi utilizada para tratar vários transtornos mentais. Atualmente a planta não é utilizada para esses fins, mas é amplamente utilizada com antidepressivo, contra os sintomas depressão leve, ansiedade, insônia, dor sensível, e ainda, atividades antivirais, e antibacterianas. Mais hoje sua principal ação é como antidepressivo.
O Hipericum perforatum, conhecido popularmente como Erva de São João ou hipérico, não pode ser utilizado sem supervisão médica. Isso porque a combinação com outros fármacos, como contraceptivos orais, ciclosporina (para evitar a rejeição em transplantes) e indinavir (para tratamento de AIDS), pode reduzir os efeitos das mesmas e interferi no tratamento do paciente. Outros medicamentos que podem perder os seus efeitos quando utilizados em conjunto com o Hipericum são: digoxina, teofilina e varfarina.
A droga baseada no Kawa Kawa e Erva de São João não pode ser vendida sem a faixa vermelha ou sem registro, se assim for devem ser retirados do mercado imediatamente. Sem o registro, não há como o Ministério da Saúde garantir a qualidade e a eficácia dos produtos à base dessas plantas, pois não existem dados analíticos sobre a biodisponibilidade na ANVISA. Os distribuidores devem prever a retirada de pontos de venda. Aqueles que desrespeitarem a suspensão podem receber multas e até o cancelamento da licença para operar o estabelecimento. A vigilância sanitária Federal e Estadual deve estar atenta e acompanhar a retirada de tais produtos nas farmácias e drogarias.
MOLÉCULAS RESPONSÁVEIS PELO EFEITO ANTIDEPRESSIVO DA ERVA DE SÃO JOÃO (ST JOHN'S WORT)
Hipericina
FARMACOLOGIA
Acredita-se que o Hiperforina seja principal componente ativo responsável pelo efeito antidepressivo dos extratos de St John's Wort. Hiperforina tem mostrado inibir a absorção dos neurotransmissores serotonina, dopamina, noradrenalina, GABA e do glutamato.
Foi identificado como um ativador específico do canal iônico TRPC6 que está envolvido no processo neuronal. A ativação das causas TRPC6 e a entrada dos de ions de sódio e cálcio nas células neuronais que pode explicar a inibição da captação do neurotransmissor.
Hiperforina também pode ser o responsável pela indução das enzimas do citocromo P450, CYP3A4 e CYP2C9 pela ligação ao receptor Pregnane X (PXR). A estrutura da Hiperforina foi elucidada por um grupo de investigação do Instituto de Shemyakin Química Bio-orgânica (Academia de Ciências da URSS em Moscou) e publicada em 1975. Não existe nenhum trabalho publicado a respeito da síntese total da Hiperforina, apesar das varias tentativas dos grupos de investigação.
OBSERVAÇÃO IMPORTANTE
ERVA DE SÃO JOÃO
Erva de São João (Hypericum perforatum) tem sido amplamente alegado como sendo eficaz como um antidepressivo. O mecanismo de ação é desconhecido; e o ingrediente ativo, se houver algum, não foi determinado. Estudos com extratos padronizados da hipericina (um dos constituintes da erva) descobriram que ela é cerca de duas vezes mais eficaz que o placebo. Alguns estudos demonstram que ela é um pouco mais eficaz que um antidepressivo padrão. Entretanto, nenhum destes estudos durou mais que seis semanas, o que não é longo o suficiente para determinar por quanto tempo a erva seria eficaz para detectar quaisquer efeitos adversos em longo prazo.
Além disso, alguns dos estudos não foram bem conduzidos. Na maioria destes estudos, o diagnóstico não foi bem estabelecido, a taxa de resposta ao placebo foi menor do que normalmente vista em estudos deste tipo, a dosagem do antidepressivo padrão foi baixa, e a dosagem da hipericina variou mais de seis vezes.
Nenhum efeito colateral grave foi relatado, mas efeitos colaterais menores incluindo desconforto gastrintestinal, fadiga, boca seca, vertigens, erupção cutânea e hipersensibilidade à luz solar. Entretanto, em fevereiro de 2000, a revista britânica Lancet publicou relatos de que a erva de São João pode interferir com a eficácia de um medicamento para a AIDS (Inidavir); uma droga imunossupressora (ciclosporina) usada para proteger pacientes após transplante cardíaco; e um anticoagulante (warfarin). Baseado neste estudo e outros relatos da literatura médica, a FDA emitiu um Conselho de Saúde Pública declarando OBSERVAÇÃO IMPORTANTE
ERVA DE SÃO JOÃO
Erva de São João (Hypericum perforatum) tem sido amplamente alegado como sendo eficaz como um antidepressivo. O mecanismo de ação é desconhecido; e o ingrediente ativo, se houver algum, não foi determinado. Estudos com extratos padronizados da hipericina (um dos constituintes da erva) descobriram que ela é cerca de duas vezes mais eficaz que o placebo. Alguns estudos demonstram que ela é um pouco mais eficaz que um antidepressivo padrão. Entretanto, nenhum destes estudos durou mais que seis semanas, o que não é longo o suficiente para determinar por quanto tempo a erva seria eficaz para detectar quaisquer efeitos adversos em longo prazo.
Além disso, alguns dos estudos não foram bem conduzidos. Na maioria destes estudos, o diagnóstico não foi bem estabelecido, a taxa de resposta ao placebo foi menor do que normalmente vista em estudos deste tipo, a dosagem do antidepressivo padrão foi baixa, e a dosagem da hipericina variou mais de seis vezes.
Nenhum efeito colateral grave foi relatado, mas efeitos colaterais menores incluindo desconforto gastrintestinal, fadiga, boca seca, vertigens, erupção cutânea e hipersensibilidade à luz solar. Entretanto, em fevereiro de 2000, a revista britânica Lancet publicou relatos de que a erva de São João pode interferir com a eficácia de um medicamento para a AIDS (Inidavir); uma droga imunossupressora (ciclosporina) usada para proteger pacientes após transplante cardíaco; e um anticoagulante (warfarin). Baseado neste estudo e outros relatos da literatura médica, a FDA emitiu um Conselho de Saúde Pública declarando que a erva de São João parece ser uma indutora de um importante mecanismo metabólico, o citocromo P450.
Como muitas drogas de prescrição usadas para tratar condições como doenças cardíacas, depressão, vertigem, certos tipos de cânceres ou prevenir condições como rejeição a transplante ou gravidez (contraceptivos orais) é metabolizada via este mecanismo, prestadores de assistência à saúde devem alertar com os pacientes sobre estes potenciais interações medicamentosas para prevenir perda do efeito terapêutico de qualquer droga metabolizada via citocromo P450.
A erva de São João não deveria ser usado por mulheres que estejam grávidas ou amamentando. Nem deveria ser usada junto com antidepressivo padrão. A potência e pureza das preparações vendidas nos Estados Unidos são desconhecidas.
BIBLIOGRAFIA
Alı Kemal Ayan; Cuneyt Cirak. 2008. Variation of hypericins in Hypericum triquetrifolium Turra growing in different locations of Turkey during plant growth Natural Product Research. 22 (18): 1597 – 1604. Bertilsson, G., Heidrich, H., Svensson, K. 2001. Identification of a human nuclear receptor defines a new signaling pathway for CYP3A4 induction. The Proceedings of the National Academy of Sciences. 95(1): 208-214.
Bilia, A.R., Gallori, S., Vincieri, F.F. 2002. St. John’s wort and depression efficacy, safety and tolerability-an update. Life Science. 70: 3077-3096.
Bystrov NS, Chernov BK, Dobrynin VN, Kolosov MN. 1975. "The structure of Hiperforin". Tetrahedron Letters 16 (32): 2791-2794.
C.A. Thomas, S. Tyagi, N. Yoshimura, M.B. Chancellor, P. Tyagi. 2007. MP-12.06: Effect of Hiperforina enriched extract on pro-ejaculatory effect of 8-OH-DPAT in anesthetized rats. Urology. 70 (3), Supplement 1. 103.
Calapai G, Crupi A, Firenzuoli F, Inferrera G, Squadrito F, Parisi A, De Sarro G, Caputi A. 2001b. Serotonin, norepinephrine and dopamine involvement in the antidepressant action of hypericum perforatum. Pharmacopsychiatry 34: 45–49.
Catherine A. Thomas, Shachi Tyagi, Naoki Yoshimura, Michael B. Chancellor, Pradeep Tyagi. 2007. Effect of Hiperforina-Enriched Extract on Pro-Ejaculatory Effect of 8-Hydroxy-2-(Di-N-Propylamino) Tetralin in Anesthetized Rats. Urology. 70 (4): 813-816.
Chatterjee SS, Bhattacharya SK, Wonnemann M, Singer A, Müller WE. 1998. "Hiperforina as a possible antidepressant component of hypericum extracts". Life Scence. 63 (6): 499–510.
De Smet PAGM, Nolen WA. 1996. St. John's wort as an antidepressant: Longer term studies are needed before it can be recommended in major depression. British Medical Journal 313: 241-242.
Evangelos C. Tatsis, Sjef Boeren, Vassiliki Exarchou, Anastassios N. Troganis, Jacques Vervoort, Ioannis P. Gerothanassis. 2007. Identification of the major constituents of Hypericum perforatum by LC/SPE/NMR and/or LC/MS. Phytochemistry. 68 (3): 383-393.
Gail B. Mahady, Yue Huang, Brian J. Doyle, Tracie Locklear. 2008. Natural products as antibacterial agents. Studies in Natural Products Chemistry. 35: 423-444.
Gaster B, Holroyd J. 2000. St. John's wort in depression. Archives of Internal Medicine 160:152-156.
Gaster, B.; Holroyd, J, H. 2000. St John’s Wort for depression: a systematic review. Archives of Internal Medicine. 160: 152-156.
Gunter P. Eckert, Jan-Henning Keller, Claudia Jourdan, Michael Karas, Dietrich A. Volmer, Manfred Schubert-Zsilavecz, Walter E. Müller. 2004. Hiperforina modifies neuronal membrane properties in vivo. Neuroscience Letters. 367 (2): 139-143.
Jin-Zhang Zeng, De-Fu Sun, Li Wang, Xihua Cao, Jian-Bin Qi, Ting Yang, Chang-Qi Hu, Wen Liu and Xiao-Kun Zhang. 2006. Hypericum sampsonii induces apoptosis and nuclear export of retinoid X receptor-alpha. Carcinogenesis 27(10): 1991–2000.
Jobst KA. 2000. Safety of St John's wort. Lancet 355: 576.
K. Treiber, A. Singer, B. Henke, W.E. Müller. 2005. P.1.11 Hiperforina inhibits serotonin uptake by activating non selective cation channels. European Neuropsychopharmacology. 15(1): S11-S12.
K. Treiber, A. Singer, B. Henke, W.E. Müller. 2006. TRP channel activation via tyrosine kinases as a novel antidepressant mechanism of action — studies with Hiperforina. European Neuropsychopharmacology. 16 (1): Page S18.
Katja Karppinen, Anja Hohtola. 2008. Molecular cloning and tissue-specific expression of two cDNAs encoding polyketide synthases from Hypericum perforatum. Journal of Plant Physiology. 165 (10): 1079-1086.
Kimberly D.P. Hammer, Matthew L. Hillwig, Jeffrey D. Neighbors, Young-Je Sim, Marian L. Kohut, David F. Wiemer, Eve S. Wurtele, Diane F. Birt. 2008. Pseudohypericin is necessary for the light-activated inhibition of prostaglandin E2 pathways by a 4 component system mimicking a Hypericum perforatum fraction. Phytochemistry. 69 (12): 2354-2362.
Leuner K, Kazanski V, Müller M. 2007. "Hiperforina-a key constituent of St. John's wort specifically activates TRPC6 channels". FASEB. 21 (14): 4101–4111.
Linda B. Moore, Bryan Goodwin, Stacey A. Jones, G. Bruce Wisely, Cosette J. Serabjit-Singh, Timothy M. Willson, Jon L. Collins, and Steven A. Kliewer. 2000. St. John's wort induces hepatic drug metabolism through activation of the pregnane X receptor. PNAS 97 (13): 7500-7502.
Linde K. 1996. St. John's wort for depression -- an overview and meta-analysis of randomised clinical trials. British Medical Journal 313: 253-258.
Ludger Beerhues. 2006. Hiperforina. Phytochemistry. 67 (20): 2201-2207.
Luiz G. Guilhermina, Luciana Ortiz, Maristela Ferigolo, Helena M.T. Barros. 2003. Commercially available Hypericum perforatum extracts do not drecrease immobility of rats in the forced swimming test. Progress in Neuro-Psychopharmacology & Biological Psychiatry. 28 (1): 49-55.
Lumpkin MM, Alpert S. Risk of drug interactions with St. John's wort and indinavir and other drugs. FDA Health Advisory, Feb 10, 2000.
Marta Menegazzi, Michela Novelli, Pascale Beffy, Valentina D’Aleo, Elisa Tedeschi, Roberto Lupi, Elisa Zoratti, Piero Marchetti, Hisanori Suzuki, Pellegrino Masiello. 2008. Protective effects of St. John's wort extract and its component Hiperforina against cytokine-induced cytotoxicity in a pancreatic β-cell line. The International Journal of Biochemistry & Cell Biology. 40 (8): 1509-1521.
Miguel A. Medina, Beatriz Martínez-Poveda, María I. Amores-Sánchez, Ana R. Quesada. 2006. Hiperforina: More than an antidepressant bioactive compound? Life Sciences. 79 (2): 105-111.
Monmaney T. Labels' potency claims often inaccurate, analysis finds. Spot check of products finds widely varying levels of key ingredient. But some firms object to testing method and defend their brands' quality. Los Angeles Times, Aug 31, 1998.
Moore L.B., Goodwin, B., Jones, S.A., Wisely, G.B., Serabjit-Singh, C.J., Willson, T.M., Collins, J.L., Kliewer, S.A. 2000. St. John’s wort induces hepatic drug metabolism through activation of the pregnane X receptor. The Proceedings of the National Academy of Sciences. 97: 7.500-7.502.
Murphy, P.A. 2002. St John’s wort and oral contraceptives: reasons for concern? Journal of Midwifery & Women's Health. 47: 447-450.
Obach, R.S. 2000. Inhibition of human cytochrome P450 enzymes by constituents of St John’s wort, an herbal preparation used in the treatment of depression. The Journal of Pharmacology and Experimental Therapeutics. 294: 88-95.
Piscitelli SC. 2000. Indinavir concentrations and St John's wort. Lancet 355: 547.
Raffaele Capasso, Francesca Borrelli, Vittorino Montanaro, Vincenzo Altieri, Francesco Capasso, Angelo A. Izzo. 2005. Effects of the Antidepressant St. John′S Wort (Hypericum perforatum) on Rat and Human Vas Deferens Contractility. The Journal of Urology. 173 (6): 2194-2197.
Roots, I., Johne, A., Schmider, J., Brockmöller, J., Maurer, A., Stömer, E., Donath, F. 2000. Interactions of herbal extract from St Jonh’s wort with amitriptyline and its metabolites. Clinical Pharmacology & Therapeutics. 67: 159.
Ruschitzka F. 2000. Acute heart transplant rejection due to Saint John's wort. Lancet 355: 548.
Schwarz, U.I., Büschel, B., Kirch, W. 2003. Unwanted pregnancy on self-medication with St. John's wort despite hormonal contraception. British Journal of clinical Pharmacology. 55:112-113.
St. John's wort study launched. Complementary and Alternative Medicine at the NIH 4(4):5, October 1997.
Stevinson, C., Ernst, E. 1999. Hypericum extract for depression: an update for the clinical evidence. European Neuropsychopharmacology. 9: 501-505.
A. Szegedi, R Kohnen, A Dienel, M Kieser. 2005. Acute treatment of moderate to severe depression with hypericum extract WS 5570 (St John’s wort): randomised controlled double blind non-inferiority trial versus paroxetina. British Medical Journal. 330(7):503-506.
Thomas CA, Tyagi S, Yoshimura N, Chancellor MB, Tyagi P. 2007. "Effect of Hiperforina-enriched extract on pro-ejaculatory effect of 8-hydroxy-2-(di-N-propylamino) tetralin in anesthetized rats". Urology. 70 (4): 813–816.
Tiziana Mennini, Marco Gobbi. 2004. The antidepressant mechanism of Hypericum perforatum. Life Sciences. 75 (9): 1021-1027.
Walter E. Müller. 2003. Current St. John’s wort research from mode of action to clinical efficacy. Pharmacological Research. 47 (2): 101-109.
Yadhu N. Singh. 2005. Potential for interaction of kava and St. John's wort with drugs. Journal of Ethnopharmacology. 100 (1-2): 108-113.
Yue, QY, Bergquist, C, Gerden B. 2000. Safety of St John’s wort (Hypericum perforatum). Lancet. 355: 576-577.
_________________________
Kava Kava - kawa kawa
Piper methysticum G. Forst (Piperáceas)
Outros nomes: Ava, Intoxicating Pepper, Kava Kava, Kawa Kawa, Kew, Sakau, Tonga, Yangona
Utilizações legais:
Na os EUA o kava é vendida como suplementos dietéticos promovidos como alternativas naturais para drogas ansiolíticas e como pílulas para dormir. Uma meta-análise de seis randomizado, controlado com placebo, em dupla ocultação de ensaios clínicos constatou que kava kava (60-200 mg/dia de kavalactones) produziu uma redução significativa da ansiedade, em comparação com placebo. No entanto, o FDA não tenha decidido sobre a capacidade dos suplementos alimentares contendo kava para fornecer tais benefícios.
USO ILÍCITO
Informações sobre a utilização ilícita de kava nos EUA é anedótico. Com base em informações obtidas na Internet, está a ser utilizado “kava lazer” para relaxar o corpo e atingir uma leve euforia. É normalmente consumido como bebida feita a partir do pó seco da raiz, com aromas e extratos em pó, líquido e extrato dissolvido em álcool puro grãos e vegetais.
Os indivíduos podem consumir 25 gramas de kavalactones, que é de cerca de 130 vezes a dose diária em kava suplementos dietéticos. Indivíduos intoxicados normalmente têm processos de pensamento sensato e abrangentes conversas, mas têm dificuldade em coordenar movimentos e muitas vezes adormecer.
Os usuários do Kava não exibem o delírio e confusão generalizada quando ocorre com altos níveis de intoxicação alcoólica. No entanto, enquanto kava sozinho não produz alterações motores e cognitivos como o álcool. O kava não potenciou o efeito produzido pelo álcool sozinho.
O Kawa-Kawa (Piper methysticum) é uma planta da família Piperácea. Trata-se de um arbusto encontrado na Malásia e nas ilhas da Polinésia, que tem sido usada há mais de 3 mil anos pelos nativos das ilhas Fiji, Samoa e Tonga, no tratamento de doenças e também em cerimônias religiosas, por causa das propriedades sedativas e relaxantes.
Durante o ritual, os nativos usam o Kawa Kawa como bebida, e acredita-se no efeito relaxante da planta, combinado com outros elementos do ritual foi interpretado como uma espécie de transe. Nos últimos anos, o Kawa Kawa tem sido destacado como uma planta de grande utilidade no tratamento de problemas como a ansiedade nervosa, estados de tensão, agitação, ansiedade e insônia.
Estudos Farmacológicos mostram que os ingredientes ativos do Kawa Kawa - as kavalactonas - promovem um efeito relaxante nos músculos, particularmente útil em situações de estresse.
O Kawa Kawa logo ganhou fama como um poderoso ansiolítico natural. Atualmente, a planta tem sido testada para que seus efeitos sejam comparados com os tradicionais benzodiazepínicos (como Valium®, Lexotan®, Diazepam, etc.). No controle da ansiedade, com resultados favoráveis para o Kawa Kawa, porque ela não apresenta os efeitos colaterais comuns aos benzodiazepínicos, como a sonolência e a função mental reduzida. Partes da planta utilizada na preparação deste remédio são as folhas secas e rizomas, transformadas em pó.
Embora o efeito da Kawa Kawa esteja sendo comprovado cientificamente, atendendo ao seu uso somente sob supervisão médica, pois a planta apresenta contra-indicações. Seu uso não é recomendado durante a gestação, lactação e em casos de Parkinson, por exemplo. Além disso, como qualquer ansiolítico, sua dosagem deve ser controlada
Estrutura geral das Kavalactonas
BIBLIOGRAFIAA. Capasso, L. Sorrentino. 2005. Pharmacological studies on the sedative and hypnotic effect of Kava kava and Passiflora extracts combination. Phytomedicine. 12 (1-2): 39-45.
André Rex, Eve Morgenstern, Heidrun Fink. 2002. Anxiolytic-like effects of Kava-Kava in the elevated plus maze test—a comparison with diazepam. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 26 (5): 855-860.
Angelo Cagnacci, Serenella Arangino, Antonietta Renzi, Anna Lisa Zanni, Stefania Malmusi, Annibale Volpe. 2003. Kava–Kava administration reduces anxiety in perimenopausal women. Maturitas. 44 (2): 103-109.
Anna Rita Bilia, Sandra Gallori, Franco F. Vincieri. 2002. Kava-kava and anxiety: Growing knowledge about the efficacy and safety. Life Sciences. 70 (22): 2581-2597.
Baum SS, Hill R, Rommelspacher H. 1998. "Effect of kava extract and individual kavapyrones on neurotransmitter levels in the nucleus accumbens of rats". Progress in Neuro-Psychopharmacology and Biological Psychiatry. 22 (7): 1105–20.
Cairney, S. 2003. Saccade and cognitive function in chronic kava users. Neuropsychopharmacology 28 (2): 389–396.
Carmen Andreescu, Benoit H. Mulsant, James E. Emanuel. 2008. Complementary and alternative medicine in the treatment of bipolar disorder — A review of the evidence. Journal of Affective Disorders. 110 (1-2): 16-26.
Clough AR, Bailie RS, Currie B. 2003. Liver function test abnormalities in users of aqueous kava extracts. Journal of Toxicology Clinical Toxicology. 41 (6): 821–829.
Cord Backhau and Josef Krieglstein. 1992. Extract of Kava (Piper methysticin) and its methysticin constituents protect brain tissue against ischemic damage in rodents. European Journal of Pharmacology. 215: 265-269.
Cynthia S. Côté, Christine Kor, Jon Cohen, Karine Auclair. 2004. Composition and biological activity of traditional and commercial kava extracts. Biochemical and Biophysical Research Communications. 322 (1): 10147-10152.
Dallas L. Clouatre. 2004. Kava kava: examining new reports of toxicity. Toxicology Letters. 150 (1): 85-96.
Dominguez Jimenez JL; Pleguezuelo Navarro M; Guiote Malpartida S; Fraga Rivas E; Montero Alvarez JL; Poyato Gonzalez A. 2007. Hepatotoxicity associated with Hypericum (St. John's wort). Gastroenterol Hepatol. 30(1): 54-55.
E. A. Carlini. 2003. Plants and the central nervous system. Pharmacology Biochemistry and Behavior. 75 (3): 501-512.
E. Ernst. 2006. Herbal remedies for anxiety – a systematic review of controlled clinical trials. Phytomedicine. 13 (3): 205-208.
F. Stickel, H. M. Baumueller, K. H. Seitz, D. Vasilakis, G. Seitz, E. G. Hahn, H. K. Seitz and D. Schuppan. 2003. Kava-induced acute liver injury: A report of 29 novel cases. Journal of Hepatology. 38 (2): 217-218.
F. Stickeland and D. Schuppan. 2007. Herbal medicine in the treatment of liver diseases. Digestive and Liver Disease. 39 (4): 293-304.
Felix Stickel, Hans-Martin Baumüller, Karlheinz Seitz, Dimitrios Vasilakis, Gerhard Seitz, Helmut K. Seitz, Detlef Schuppan. 2003. Hepatitis induced by Kava (Piper methysticum rhizoma). Journal of Hepatology, 39 (1): 62-67.
H. Barton Grossman. 2006. Is adjuvant chemotherapy for bladder cancer safer in patients with an ileal conduit than a neobladder? Manoharan M, Reyes MA, Kava BR, Singal R, Kim SS, Soloway, MS, Department of Urology, University of Miami School of Medicine, Miami, FL. Urologic Oncology: Seminars and Original Investigations, 24 (3): 272.
H. Wong. 2003. Potential hepatotoxicity from complementary and alternative medicine (CAM)/dietary supplements (DS) containing comfrey, chaparral, and Kava Kava. Journal of Allergy and Clinical Immunology. 111 (1): Suppl 2, S167.
Holstege CP; Mitchell K; Barlotta K; Furbee RB. 2005. Toxicity and drug interactions associated with herbal products: ephedra and St. John's Wort. Medical Clinics of North America. 89(6): 1225-1257.
Hu, A. 2005. "Determination of six kavalactones in dietary supplements and selected functional foods containing Piper methysticum by isocratic liquid chromatography with internal standard". Journal of AOAC International. 88 (1): 16–25.
Hyla Cass. 2004. Herbs for the nervous system: Ginkgo, kava, valerian, passionflower. Seminars in Integrative Medicine. 2 (2): 82-88.
J. Anke, S. Fu and I. Ramzan. 2006. Kavalactones fail to inhibit alcohol dehydrogenase in vitro. Phytomedicine. 13 (3): 192-195.
J. Le Bot, S. Adamowicz 1, P. Robin. 1997. Modelling plant nutrition of horticultural crops: a review. Scientia Horticulturae 74: 47–82
Jioji N Tabudravu1, Marcel Jaspars. 2005. Anticancer activities of constituents of kava (Piper methysticum) The South Pacific. Journal of Natural Science. 23: 26-29.
Johannes Schulze, Walter Raasch, Claus-Peter Siegers. 2003. Toxicity of kava pyrones, drug safety and precautions – a case study. Phytomedicine. 10 (4): 68-73.
Juan Perez and James F. Holmes. 2005. Altered mental status and ataxia secondary to acute Kava ingestion. Journal of Emergency Medicine. 28 (1): 49-51.
Kapusta M; Dusek J. 2003. Therapeutic and toxicologic aspects of biological effects of Saint John's wort (Hypericum perforatum L.). Ceská a Slovenská Farmaice. 52(1): 20-28.
Klohs, M. W., Keller, F., Williams, R. E., Toekes, M. I. and Cronheim, G. E. 1959. A chemical and pharmacological investigation of Piper methysticum, Forster. Journal of Medicinal and Pharmacological Chemistry 1: 95-103.
L. Sorrentino, A. Capasso and M. Schmidt. 2006. Safety of ethanolic kava extract: Results of a study of chronic toxicity in rats. Phytomedicine. 13 (8): 542-549.
Lim ST, Dragull K, Tang CS, Bittenbender HC, Efird JT, Nerurkar PV 2007. "Effects of kava alkaloid, pipermethystine, and kavalactones on oxidative stress and cytochrome P450 in F-344 rats". Toxicological Sciences. 97 (1): 214–221.
Marcello Spinella. 2001. Herbal Medicines and Epilepsy: The Potential for Benefit and Adverse Effects. Epilepsy & Behavior. 2 (6): 524-532.
Moreno, Ricardo Alberto; Teng, Chei Tung; Almeida, Karla Mathias de; Tavares Junior, Hildeberto. 2006. Hypericum perforatum versus fluoxetine in the treatment of mild to moderate depression: a randomized double-blind trial in a Brazilian sample. Revista Brasileira de Psiquiatria. 28(1): 29-32.
Oliver Meissner, Hanns Häberlein. 2005. HPLC analysis of flavokavins and kavapyrones from Piper methysticum Forst. Journal of Chromatography B, 826 (1-2): 46-49.
Peter A. Whitton, Andrew Lau, Alicia Salisbury, Julie Whitehouse and Christine S. Evans. 2003. Kava lactones and the kava-kava controversy. Phytochemistry. 64 (3): 673-679.
Pilkington K; Boshnakova A; Richardson J. 2006. St John's wort for depression: time for a different perspective? Complementary Therapies in Medicine. 14(4): 268-281.
R. Teschke, W. Gaus, D. Loew. 2003. Kava extracts: Safety and risks including rare hepatotoxicity. Phytomedicine. 10 (5): 440-446.
Robert A. DiSilvestro, Wenyi Zhang and David J. DiSilvestro. 2007. Kava feeding in rats does not cause liver injury nor enhance galactosamine-induced hepatitis. Food and Chemical Toxicology. 45 (7): 1293-1300.
Robert Grace Mbbs, Fanzca, Fracp, Mmed. 2005. Kava-induced urticaria. Journal of the American Academy of Dermatology. 53 (5): 906.
S.Y. Mills, B. Steinhoff. 2003. Kava-kava: a lesson for the phytomedicine community. Phytomedicine. 10 (2-3): 261-262.
Saskia Lüde, Michael Török, Sandy Dieterle, René Jäggi, Karin Berger Büter and Stephan Krähenbühl. 2008. Hepatocellular toxicity of kava leaf and root extracts. Phytomedicine 15, (1-2): 120-131.
Seitz U, Schüle A, Gleitz J. 1997. [3H]-monoamine uptake inhibition properties of kava pyrones. Planta Medica. 63 (6): 548–549.
Shulgin, A. 1973. "The narcotic pepper - the chemistry and pharmacology of Piper methysticum and related species" Bulletin on narcotics. 25 (59): 59–74.
Siegfried Lehrl. 2004. Corrigendum to “Clinical efficacy of kava extract WS® 1490 in sleep disturbances associated with anxiety disorders. Results of a multicenter, randomized, placebo-controlled, double-blind clinical trial” Journal of Affective Disorders. 78: 101–110.
Sorrentino L, Capasso A, Schmidt M. 2006. Safety of ethanolic kava extract: Results of a study of chronic toxicity in rats. Phytomedicine 13 (8): 542–549.
Tran Dang Xuan, Ogushi Yuichi, Chikara Junko, Eiji Tsuzuki, Terao Hiroyuki, Matsuo Mitsuhiro, Tran Dang Khanh, Nguyen Huu Hong. 2003. Kava root (Piper methysticum L.) as a potential natural herbicide and fungicide. Crop Protection. 22 (6): 873-881.
Yadhu N. Singh. 2005. Potential for interaction of kava and St. John's wort with drugs. Journal of Ethnopharmacology. 100 (1-2): 108-113.
Yuzhong Ma, Karuna Sachdeva, Jirong Liu, Michael Ford, Dongfang Yang, Ikhlas A. Khan, Clinton O. Chichester, and Bingfang Yan. 2004. Desmethoxyyangonin and Dihydromethysticin are Two Major Pharmacological Kavalactones with Marked Activity on the Induction of Cyp3a23. Drug Metabolism and Disposition. 32 (11): 1317–1324.
__________________________
ECHINACEA
Echinacea purpurea (L) Moench (Asteraceae)
Família: Compositae (Daisy) - Asteraceae (aster)
Outros nomes comuns: Red Sunflower, Purple Coneflower, Black Sampson, Hedgehog, Coneflower, Snake Root, Sampson Root, Rudbeckia, Comb Flower, Indian Head.
Echinacea, comumente conhecida pelo seu nome popular em Inglês “Purple Coneflower”, é um gênero de nove espécies de plantas herbáceas da Família das Asteraceae. Ela é estritamente nativa da região leste e central da América do Norte. As plantas têm grandes, compostas de ostentação chefes de flores, florescimento. Algumas dessas espécies são utilizadas como remédio.
O gênero é a partir do nome grego echino, que significa "espinhoso", devido aos espinhos no disco central. Eles são herbáceas, planta perene, crescendo 1 ou 2 m de altura. As folhas são elípticas a lanceoladas, 10 - 20 cm de comprimento. Como todas as Asteraceae, as flores são umas compósitas inflorescências, com roxo (raramente amarelo ou branco) disposto em uma proeminência, algo em forma de cone de cabeça - "forma de cone", porque as pétalas de raios florets exteriorizam e tende para baixo, uma vez aberta, a flor com a cabeça em forma um cone.
HISTÓRIA
Echinacea purpurea é uma herbácea, planta perene que é nativa nas planícies do oeste americano e tem sido largamente cultivada na Europa, onde é pensado para ser talvez o mais poderoso antibiótico natural.
Os dois pés de plantas podem ser encontrados crescendo em pradarias secas e outros lugares abertos, florescente, com o solo bem drenado. Echinacea, o nome é derivado do grego, echinos, significando "ouriço" ou "ouriço do mar".
Existem três espécies deste gênero que incluem muitas das mesmas propriedades e aplicações (E. purpurea, E. angustifolia e E. pallida), e são frequentemente utilizados alternadamente. Nativos americanos utilizaram à roxa “coneflower” mais do que qualquer outra planta no tratamento de doenças e lesões, incluindo mordida de cobra, febre, feridas, queimaduras, infecções e dor de dente.
Com os primeiros colonos a Echinacea foi adaptada como um remédio para as constipações e gripe, e da erva-americana se tornou popular entre as plantas medicinais e a medicina tradicional.
A erva foi incluído no Formulário Nacional, do Livro dos Farmacêuticos de consulta, a partir de 1915, e depois em 1950, apesar da perda da Echinacea na América após a década de 1930, ela foi “redescoberta” na década de 80 do século passado, devido ao crescente interesse no Sistema Imunitário, Síndrome de fadiga crônica, câncer, candidíase, etc. Geralmente acreditavam que Echinacea purpurea é o mais potente dos três, e sendo mais facilmente cultivadas, também a mais usada.
E. purpurea também se pensa ser a mais eficaz como uma espécie desintoxicante e sistema imunológico detonadora, particularmente em situações respiratórias, e a Equinácea foi aprovada pelos praticantes Ayurveda.
Há agora muito interesse renovado dos Estados Unidos, por causa da erva e do efeito positivo sobre o sistema imunológico, e as ervas alcançaram fama mundial por sua ação antiviral, antifúngica e propriedades antibacterianas, estes dados basear-se em documentação científica recente.
Echinacea contém um antibiótico natural chamado echinacoside (um glicosídeo) e um composto chamado echinaceina (uma amida). Ambas as componentes neutralizar as enzimas produzidas por micróbios que atacam e invadem células tecidas saudáveis.
Outros componentes incluem ácidos graxos, óleos essenciais, quercetina, alcalóides, polissacarídeos, alkamides, frutanos, carboidratos, germacreno, humuleno, limoneno, myrcene, pineno alfa, beta-pineno, kaempferol, rutina, cafeico-, - clorogênicos, catárico e palmítico Ácido, terpenóides, vitamina B1, B2, B3 e vitamina C, ferro, cálcio, magnésio, manganês, fósforo, potássio, selénio, zinco, flavonóides, beta-caroteno e de outros nutrientes importantes.
EFEITO MEDICINAL
Pelo menos um estudo mostra que a Echinacea purpurea têm propriedades antidepressivas. Esta ficha fornece informações básicas sobre a erva. Inclui flores, folhas, cascas, frutos, sementes, caules e raízes. São nove espécies conhecidas de echinacea, sendo que todas são nativas do sul dos Estados Unidos e Canadá. O mais comumente usado, Echinacea purpurea, acredita-se ser o mais potente.
Pelo menos um estudo mostra Echinacea purpurea tem propriedades antidepressivas. Esta ficha fornece informações básicas sobre a erva. Uma planta ou parte de uma planta utilizada para o seu sabor, aroma, propriedades terapêutica ou potencial. Inclui flores, folhas, cascas, frutos, sementes, caules e raízes.
Efeitos colaterais e advertências
Poucos efeitos colaterais de echinacea são relatados quando ele é usado nas doses recomendadas. Queixas relatadas incluem desconforto gástrico, náuseas, dor de garganta, erupção cutânea (alérgicas, urticária, ou nódulos dolorosos chamados "eritema nodoso"), sonolência, dores de cabeça, tonturas e dores musculares.
Raros casos de hepatite (inflamação hepática), insuficiência renal, cardíaca ou irregular (fibrilação atrial) têm sido relatadas em pessoas que tomam echinacea, embora não sejam claro que estas eram devidas a echinacea.
Injetada a echinacea pode alterar níveis de açúcar no sangue e causar reações graves e devem ser evitados. Echinacea tem sido associada a um aumento da incidência de exantema em crianças, e, portanto, os riscos da utilização maior superam os potenciais benefícios.
Púrpura trombocitopênica trombótica (TTP) também tem sido relatado. Alguns especialistas em medicina natural desencorajar o uso de echinacea por pessoas com condições que afetam o sistema imunitário, tais como o HIV/SIDA, alguns tipos de câncer, esclerose múltipla, tuberculose, e doenças reumatológica (tais como artrite reumatóide ou lupus).
No entanto, existe uma falta de relatórios ou estudos específicos nesta área, e os riscos do uso da echinacea com estas condições não estão claras. O uso em longo prazo desta erva pode causar baixa de glóbulos brancos (leucopenia).
Doentes com transplante hepático que consomem grandes quantidades de echinacea podem ter aumentado à atividade de enzimas hepáticas, que muitas vezes indicam dano hepático. Embora a relevância de tal não seja clara, doentes com transplante hepático, a echinacea deve ser usada com cautela devido a seus potenciais perigos*.
*O Autor não aconselha o uso desta planta em transplantados
Gravidez e Aleitamento Materno
Neste momento, echinacea não podem ser recomendados durante a gravidez ou amamentação. Embora estudos preliminares mostrem nenhum efeito sobre a gravidez, não há investigação aprofundada nesta área. As mulheres grávidas devem evitar tinturas devido ao alto potencial do teor alcoólico.
Com uma reputação como o melhor da natureza potencializador do sistema imunológico, Echinacea purpurea acredita-se ser um dos mais poderosos da natureza como antibiótico natural. Considerado o mais potente do gênero Echinacea, Echinacea purpurea ajuda a estimular as resistências do organismo a infecções, doenças, febre e septicemia.
UTILIZAÇÃO BENÉFICA
Echinacea purpurea obras: auxilia o sistema imunológico contra a ameaça de doenças e infecções. Há evidências de que ele pode simular a ação do interferon, uma substancia natural que é capaz de blindagem de células a partir de invasão viral. Considerado um antiviral e antibacteriano, Echinacea não só mata bactérias e vírus, mas também na realidade a imunidade é reforçada através do aumento do número de glóbulos brancos no sangue.
Segundo os investigadores alemães, a erva é dito para aumentar os níveis de infecção de combate a células T de trinta por cento, construindo assim resistência imunológica. E relatou que a Comissão demonstrou E. purpurea apresenta efeitos imunoestimulante de várias maneiras: O número de glóbulos brancos e células do baço estão aumentados, a capacidade de fagocitose por granulócitos humano é ativado, e se elevou à temperatura corporal.
O chá é hoje considerado um dos mais eficazes desitoxicantes na medicina popular ocidental contra problemas: circulatório, respiratório e o sistema linfático, especialmente. E. purpurea, que é considerado mais potente do que outras espécies. É um excelente Tonico linfático, limpeza do sistema de materiais tóxicos, e pode ser particularmente útil nos casos de gânglios inchados e contra hipertrofia da próstata.
Um maior apoio do papel da Echinacea como um depurativo, ou agente que tende a limpar e purificar o sangue pelo assassinato contaminante no sangue, a erva acredita-se ser eficaz no tratamento do envenenamento do sangue e septicemia.
O chá também a partir do estômago ajuda a expulsar venenos, toxinas, pus e formações de abscessos no corpo. Além disso, como um agente de produção de suor. Referido como um antifúngico, Echinacea purpurea é dito para ser eficaz contra infecções vaginal de levedura, como a Cândida, e de outras infecções fúngicas.
Echinacea purpurea está sendo investigada por sua possível propriedades anticancerígena indireta, através dos seus efeitos de reforço imunológico geral. A estimulação da erva de polissacarídeos e fitoesteróis são particularmente importantes, porque são os ingredientes que aparecem para ativar macrófagos, os agentes que engolir e digerir células tumor ais e destruir bactérias, vírus e agentes infecciosos. De acordo com Loyola University Health System informação, algumas doenças malignas têm sido tratadas com Echinacea e junto com o efeito da quimioterapia pode ser melhorado.
Ao primeiro sinal de um resfriado, gripe, febre, dor de ouvido ou quando for necessária uma ação antibiótica, tomar Echinacea.
Diz-se contra a ameaça de infecções, ou pelo menos diminuir sua extensão e gravidade. Para a prevenção e o tratamento de infecções do trato respiratório superior, E. purpurea acredita-se ser o mais potente das espécies de Echinacea para esta indicação e tem sido útil em casos de bronquite.
Echinacea é considerado um antibiótico e anti-séptico que tem uma reputação de combate qualquer tipo de infecção, bactérias, vírus e germes como nenhum outro e foi pensada para ser eficaz no tratamento da infecção urinária, infecção Staph, infecção nos rins, intoxicação alimentar, picadas venenosas (cobras e insetos), sífilis, difteria e outras febres pútridas. Na Alemanha, é utilizado para combater bronquite e abscessos.
Echinacea é chamado de um antiinflamatório e um eficaz agente que trabalha para reduzir a dor e o inchaço e combate as lesões de todos os tipos de inflamação, incluindo dor de garganta, amidalite e hemorróidas. Acredita-se que a Echinacea purpurea promover regeneração tecidual.
É considerada uma "alternativa", ou erva que gradualmente converte um órgão em condição insalubre para um órgão saudável e facilita gradualmente mudanças benéficas no organismo. Echinacea purpurea é dito para promover a boa digestão e ajudar a aliviar flatulência
Usado tanto interno como externamente. Os efeitos da Echinacea como uma cura para todos os tipos de problemas de pele e infecções são lendários, ajudando a aliviar cortes, o frio ferido, furúnculos, carbúnculos, acne, herpes e gangrena.
Uma das suas propriedades químicas, chamado echinaceina, não é só pensamento para repelir micróbios, mas também estimular a reparação de células da pele. Topicamente, tem sido utilizado para aliviar o sol na pele, eczema infectado ou chorando, intoxicação por planta (hera, etc.), lesões de herpes, feridas infectadas e outras doenças da pele.
** Fornecida benéfica em investigação propriamente dita que as pessoas envolvidas, subscrito pela Comissão da Alemanha para uso terapêutico, tais como: Dor, Bronquite, constipações, tosse, febre, gripe, HIV, sistema imunológico, Depressão, Infecções (Incluindo Listeria, Lyme Doença, Tricomoníase, e Tifo), Meningite, Inflamação da Boca, Papeira, faringite, problemas respiratórios, infecções do trato urinário, insuficiência glóbulos brancos (leucopenia) e feridos.
** Desde que as investigações não envolvem seres humanos.
BIBLIOGRAFIA
B. Barrett. 2003. Medicinal properties of Echinacea: A critical review. Phytomedicine. 10 (1): 66-86.
B. Dave Oomah, Delphine Dumon, Anaberta Cardador-Martínez, David V. Godfrey. 2006. Characteristics of Echinacea seed oil. Food Chemistry. 96 (2): 304-312.
Barrett BP, Brown RL, Locken K. 2002. Treatment of the common cold with unrefined echinacea: a randomized, Double-blind, placebo-controlled trial. Annals of Internal Medicine. 137(12): 939–946.
E. Schwarz, A. Parlesak, H.-H. Henneicke-von Zepelin, J.C. Bode, C. Bode. 2005. Effect of oral administration of freshly pressed juice of Echinacea purpurea on the number of various subpopulations of B- and T-lymphocytes in healthy volunteers: Results of a Double-blind, placebo-controlled cross-over study. Phytomedicine. 12 (9): 625-631.
Ferdinand Bohlmann, Horst Hoffmann. 1983. Further amides from Echinacea purpurea. Phytochemistry. 22 (5): 1173-1175.
Giulia Di Carlo, Immacolata Nuzzo, Raffaele Capasso, Maria Rosaria Sanges, Emilia Galdiero, Francesco Capasso, Caterina Romano Carratelli. 2003. Modulation of apoptosis in mice treated with Echinacea and St. John’s wort. Pharmacological Research. 48 (3): 273-277.
Kemp DE, Franco KN. 2002. Possible leukopenia associated with long-term use of echinacea. The Journal of the American Board of Family Medicine. 15(5): 417-419.
L.J. Clifford, M.G. Nair, J. Rana, D.L. Dewitt. 2002. Bioactivity of alkamides isolated from Echinacea purpurea (L.) Moench. Phytomedicine. 9 (3): 249-253.
Tanha Patel, Audra Crouch, Kayla Dowless, David Freier. 2008. 122 Acute effects of oral administration of a glycerol extract of Echinacea purpurea on peritoneal exudate cells in female swiss mice. Brain, Behavior, and Immunity. 22 (4), Supplement 1. Page 39.
Taylor JA, Weber W, Standish L. 2003. Efficacy and safety of echinacea in treating upper respiratory tract infections in children: a randomized controlled trial. Journal of the American Medical Association. 290 (21): 2824–2830.
V. A. Kurkin, A. V. Dubishchev, V. N. Ezhkov, I. N. Titova, and E. V. Avdeeva1. 2006. Antidepressant Activity of some phytopharmaceuticals and phenylpropanoids. Pharmaceutical Chemistry Journal. 40 (11): 33 – 38
________________________
MARACUJÁ
Passiflora incarnata e edulis (Passifloraceae).
O gênero Passiflora compreende cerca de 500 espécies, é o maior da Família das Passifloraceae (flor da Paixão). A espécie deste gênero está distribuída nas regiões tropicais e temperada quentes do Novo Mundo, pois ela é muito rara na Ásia, Austrália e África tropical.
Passiflora incarnata L., também conhecido como Maypop, Maracujá ou Paixão flor, é uma conhecida planta medicinal nativa da América nas áreas tropicais. Ela é utilizada para o tratamento da ansiedade, nervosismo e neuralgia, e foi recomendado no início do século, para insônia e para menopausa.
Efeito Ansiolítico e sedativo tem sido observado em roedores. Passiflora edulis tem uma grande propagação de plantas cultivadas em torno de todos os países tropicais do mundo. No Brasil, os frutos são comumente conhecidos como "Maracujá" com polpa de frutas e um delicioso suco de rendimentos, que é exportada para vários países. Durante a produção industrial do "suco de Maracujá".
HISTÓRIA
O uso de Passiflora como um remédio foi louvado pela primeira vez por um investigador espanhol de nome Monardus no Peru em 1569 como as belas flores de Passiflora apareceram-lhe para ser o símbolo da Paixão de Cristo. Várias espécies de Passiflora têm sido amplamente utilizadas na terapêutica tradicional em muitos países.
INDICAÇÃO POPULAR
Passiflora incarnata é um remédio popular tradicional na Europa, bem como um medicamento homeopático para insônia, ansiedade, e tem sido usado como um chá sedativo na América do Norte.
A planta tem sido usada como analgésico, antiespasmódico, antiasmático, e sedativos no Brasil, como sedativo e de estupefacientes no Iraque; doente em condições similares de dismenorréia, epilepsia, insônia, neurose e nevralgias, na Turquia; para curar a histeria e a neurastenia na Polônia, na diarréia, dismenorréia, nevralgias, queimaduras, hemorróidas e insônia na América.
EFEITO FARMACOLÓGICO
Passiflora incarnata
Maltol, um derivativado y-benzopirona, e etílico maltol foram avaliados por seus efeitos depressores-SNC. Foi relatado que o Maltol e o Maltol etílico potencialisa o sono induzida-hexobarbital, inibe as convulsões induzidas pelo pentilenetetrazol por anfetamina também diminuiu hiperatividade em ratos.
Maltol Etílico foi relatado por um potente anti-convulsivante do que maltol, mas comparativamente menos potente na diminuição da atividade espontânea motora.
Passiflora edulis
Extrato aquoso de Passiflora edulis tem sido relatado por não apresentar efeitos depressores do SNC específicos em camundongos, ratos e humanos voluntários saudáveis. “Foi também sublinhado que algumas amostras de Passiflora edulis não tiveram um efeito sedativo específico” SNC.
O uso tradicional atribuido as propriedades sedativas do maracujá, ansiolíticas e antiespasmódicas, são parcialmente confirmados por experiência em animais.
TOXICOLOGY
• Embora remédios à base de plantas sejam geralmente considerados seguros, no entanto, a FDA dos Estados Unidos têm relatado 15 casos ocorridos de toxicidade devido ao consumo de multi-ingrediente.
• Passiflora edulis demonstrou toxicidade hepatobiliar e pancreática em animais e em seres humanos. Por outro lado, a Passiflora incarnata é listada como "segura como sedativo" pelo FDA dos U.S.A. A passoflora é considerada com um efeito muito, foi aconselhado fazer uso da Passiflora incarnata com precaução quando tomado juntamente com outros estimulantes ou depressoras do SNC.
• A revista popular americana E.U. “O Farmacêutico” desencorajou o uso de Passiflora incarnato em mães lactantes (E.U. O Farmacêutico, 2001). Devido à presença do alcalóido passiflorine e harmina, a planta é relatada como uma erva em geral tóxico pela Universidade da Califórnia em seu Boletim Informativo “Ambiental Toxicológico”.
• Os efeitos nocivos do alcalóide harmala presente na Passiflora incarnata foram contabilizados e o seu efeito colateral em longo prazo da prescrição do alcalóide foi estritamente proibido na Austrália.
NOTA
O maracujá roxo escuro (por exemplo, no Quênia) é menor do que um limão, enrugada courato na maturidade. A variedade roxa da fruta se tem informação da presença de vestígios de glicósidos cianogênicas e, portanto, são levemente venenosas.
AVALIAÇÃO
De acordo com o trabalho de Kamaldeep Dhawan et al (2001) a correta identidade de Passiflora incarnata e Passiflora edulis foi recentemente criada usando vários parâmetros. Para reforçar estas conclusões, a atividade ansiolítica destas duas plantas é controversa, e têm sido amplamente investigadas.
O extrato metanólico de Passiflora incarnata apresentou significativa atividade ansiolítica em uma dose oral de 125 mg/kg, enquanto que Passiflora edulis foi desprovida de qualquer atividade significativa.
BIBLIOGRAFIA
A. J. Vargas, D.S. Geremias, G. Provensi, P.E. Fornari, F.H. Reginatto, G. Gosmann, E.P. Schenkel, T.S. Fröde. 2007. Passiflora alata and Passiflora edulis spray-dried aqueous extracts inhibit inflammation in mouse model of pleurisy. Fitoterapia. 78 (2): 112-119.
Ana Beatriz Montanher, Silvana Maria Zucolotto, Eloir Paulo Schenkel, Tânia Silvia Fröde. 2007. Evidence of anti-inflammatory effects of Passiflora edulis in an inflammation model. Journal of Ethnopharmacology. 109 (2): 281-288.
Aoyagi, N., Kimura, R., Murata, T., 1974. Passiflora incarnata dry extract. I. Isolation of maltol and pharmacological action of maltol and ethyl maltol. Chemical and Pharmaceutical Bulletin. 22: 1008–1013.
E. Speroni and Minghetti. 1988. Neuropharmacological activity of extracts from Passiflora Incarnata. Planta Medica. 54(6): 488-491.
Eliana Rodrigues, Ricardo Tabach, José Carlos F Galduróz, Giuseppina Negri. 2008. Plants with possible anxiolytic and/or hypnotic effects indicated by three Brazilian cultures — Indians, Afro-Brazilians, and river-dwellers. Studies in Natural Products Chemistry. 35: 549-595.
Fabiana Antognoni, Suiping Zheng, Cristina Pagnucco, Rita Baraldi, Ferruccio Poli, Stefania Biondi. 2007. Induction of flavonoid production by UV-B radiation in Passiflora quadrangularis callus cultures. Fitoterapia. 78 (5): 345-352.
H.R. Chaudhry, R. Taj, N. Saeed, N.H. Khan, A. Chaudary, A.J.M. Loonen. 2007. P.2.g.006 Effectiveness of a combination of Hypericum and Passiflora for the treatment of depression with concomitant anxiety. European Neuropsychopharmacology. 17 (4): S394.
J.T. Doyama, H.G. Rodrigues, E.L.B. Novelli, E. Cereda, W. Vilegas, 2005. Chemical investigation and effects of the tea of Passiflora alata on biochemical parameters in rats. Journal of Ethnopharmacology. 96: 371-374.
Jucélia Pizzetti Benincá, Ana Beatriz Montanher, Silvana Maria Zucolotto, Eloir Paulo Schenkel, Tania Silvia Fröde. 2007. Evaluation of the anti-inflammatory efficacy of Passiflora edulis. Food Chemistry. 104 (3): 1097-1105.
Judith Jiménez, Leticia Riverón-Negrete, Fikrat Abdullaev, Javier Espinosa-Aguirre, Rosario Rodríguez-Arnaiz. 2008. Cytotoxicity of the β-carboline alkaloids harmine and harmaline in human cell assays in vitro. Experimental and Toxicologic Pathology. 60 (4-5): 381-389.
Kacem Rharrabe, Ahmed Bakrim, Naima Ghailani, Fouad Sayah. 2007. Bioinsecticidal effect of harmaline on Plodia interpunctella development (Lepidoptera: Pyralidae) Pesticide. Biochemistry and Physiology. 89 (2): 137-145.
Kamaldeep Dhawan, Sanju Dhawan, Anupam Sharma, 2004. Passiflora: Reviews update. Journal of Ethnopharmacology. 94: 1-23.
Kamaldeep Dhawan, Suresh Kumar and Anupam Sharma. 2001. Comparative biological activity study on Passiflora incarnata and Passiflora edulis. Fitoterapia. 72 (6): 698-702.
Kamaldeep Dhawan, Suresh Kumar, Anupam Sharma, 2001. Anti-anxiety studies on extracts of Passiflora incarnata Linneaus. Journal of Ethnopharmacology 78: 165-170.
Kamaldeep Dhawan, Suresh Kumar, Anupam Sharma., 2001. Anxiolytic activity of aerial and underground parts of Passiflora incarnate. Fitoterapia. 72: 922-926.
Luiz F. Lolli, Cláudia M. Sato, Cássia V. Romanini, Larissa De Biaggi Villas-Boas, Cid A. Moraes Santos, Rúbia M.W. de Oliveira. 2007. Possible involvement of GABAA-benzodiazepine receptor in the anxiolytic-like effect induced by Passiflora actinia extracts in mice. Journal of Ethnopharmacology. 111 (2): 308-314.
M. Rudnicki, M.M. Silveira, T.V. Pereira, M.R. Oliveira, F.H. Reginatto, F. Dal-Pizzol, J.C.F. Moreira. 2007. Protective effects of Passiflora alata extract pretreatment on carbon tetrachloride induced oxidative damage in rats. Food and Chemical Toxicology. 45 (4): 656-661.
Rachid Soulimani, Chafique Younos, Salah Jarmouni, Dalila Bousta, René Misslin and François Mortier. 1997. Behavioural affects of Passiflora incarnata L. and its indole alkaloid and flavonoid derivatives and maltol in the mouse. Journal of Ethnopharmacology. 57 (1): 11-20.
Shahin Akhondzadeh , MR Mohammadi & F Momeni. 2005. Passiflora incarnata in the treatment of attention-deficit hyperactivity disorder in children and adolescents. Therapy. 2(4): 609-614.
Thomas Stöhr, Delphine Lekieffre, Joachim Freitag. 2008. Lacosamide, the new anticonvulsant, effectively reduces harmaline-induced tremors in rats. European Journal of Pharmacology. 589 (1-3): 114-116.
______________________________
sexta-feira, 5 de fevereiro de 2010
ALGUNS EXEMPLOS DE ESPÉCIES ADAPTÓGENAS
Panax ginseng L. (Araliaceae)
Ginseng (Panax ginseng, Panax quiquefolius, Panax sp)
O ginseng (Panax sp.) é muito utilizada na china para aumentar a longevidade e a qualidade de vida. A parte utilizada pela população é a sua raiz. Existe varias espécies do gênero ginseng, Panax quiquefolius (ginseng americano), cultivada no oeste do EUA e exportada para a China em grandes quantidades. A parte desta planta utilizada pela população é sua raiz. A raiz desta planta é conhecida a mais de 5000 anos no Oriente. Citada pela primeira vez durante a Dinastia Han.
Raizes de Ginseng
O que se encontrou cientificamente sobre o ginseng
Tem sido muito difícil identificar as vantagens terapêuticas do ginseng, uma vez que existem vários estudos contraditórios sobre seus efeitos terapêuticos, provavelmente à grande variedade da planta nos estudos. Já que existem 11 espécies da família Araliaceae. Elas cressem principalmente no hemisfério norte, normalmente em climas frios.
Foi identificado no Panax ginseng panaxanos, substância que pode reduzir o açúcar do sangue, e fortalece o sistema imunológico, ainda apresenta uma ação afrodisíaca. Por outro lado, o Ginseng é caracterizado pela presença de ginsenosideos.
A estrutura dos ginsenosídeos
Ginseng brasileiro
Pfaffia paniculata Mart O. Kuntze. (Amaranthaceae)
O gênero Pfaffia tem recebido grande destaque devido às suas qualidades medicinais de algumas de suas espécies. A Pfaffia glomerata, subarbusto do Pantanal argiloso vem sendo considerado como alternativo econômico para a região.
Pfaffia paniculada-Suma
Suma, também conhecido como ginseng brasileiro é um Tonico geral, imunoestimulante, antiinflamatório, anti-reumático. Encontrada na Amazônia.
A presença de saponinas pode chegar até 11%, estes são glicosídeos e nortriterpenos, e foram patenteados como antitumoral. Apresenta ainda as vitaminas A, B1, B12, C, D, E, F, acido fólico, acido nicotínico, acido pantatênico.
Regenerador celular
Pfaffia paniculada é útil no auxilio do tratamento da diabetes, fadiga crônica, aumento do colesterol e contra o acido úrico, em relação a gota e artrite.
BIBLIOGRAFIA
Caso Marasco A, Vargas Ruiz R, Salas Villagomez A, Begona Infante C. (1996). "Double-blind study of a multivitamin complex supplemented with ginseng extract". Drugs Exp Clin Res. 22 (6): 323–329.
Chinese Herbal Medicine: Materia Medica, Third Edition by Dan Bensky, Steven Clavey, Erich Stoger, and Andrew Gamble 2004.
Churchill, J.D., Gerson, J.L., Hinton, K.A., Mifek, J.L., Walter, M.J., Winslow, C.L., Deyo, R.A., 2002. The nootropicproperties of ginseng saponin Rb1 are linked to effects on anxiety. Integrative Physiological and Behavioral Science 37:178–187.
Davydov M, Krikorian A. D. 2000. "Eleutherococcus senticosus (Rupr. & Maxim.) Maxim. (Araliaceae) as an adaptogen: a closer look". Journal of Ethnopharmacology 72 (3): 345–393.
De Andrade E; de Mesquita AA; Claro Jde A; de Andrade PM; Ortiz V; Paranhos M; SrougiM Study of the efficacy of Korean Red Ginseng in the treatment of erectile dysfunction. Sector of Sexual Medicine, Division of Urological Clinic of Sao Paulo University, Sao Paulo, Brazil.
Hong B, Ji YH, Hong JH, Nam KY, Ahn TY. 2002. "A double-blind crossover study evaluating the efficacy of Korean red ginseng in patients with erectile dysfunction: a preliminary report". Journal of Urology 168 (5): 20–21.
Hong B; Ji YH; Hong JH; Nam KY. 2002. TYA double-blind crossover study evaluating the efficacy of korean red ginseng in patients with erectile dysfunction: a preliminary report. Journal Urology.; 168(5): 2070-2073.
Lewis WH, Zenger VE, Lynch RG.1983. "No adaptogen response of mice to ginseng and Eleutherococcus infusions". Journal of Ethnopharmacology 8 (2): 209–214.
McElhaney J. E. 2004. "A placebo-controlled trial of a proprietary extract of North American ginseng (CVT-E002) to prevent acute respiratory illness in institutionalized older adults". Journal of the American Geriatrics Society. 52 (1): 13–19.
Murphy and Lee Ginseng. 2002. Sex behavior, and nitric oxide. Annals of the New York Academy of Sciences. 962: 372-377.
Shin HR, Kim JY, Yun TK, Morgan G, Vainio H. 2000. "The cancer-preventive potential of Panax ginseng: a review of human and experimental evidence". Cancer Causes Control 11 (6): 565–576.
Suh SO, Kroh M, Kim NR, Joh YG, Cho MY. 2002. "Effects of red ginseng upon postoperative immunity and survival in patients with stage III gastric cancer". American Journal of Chinese Medicine. 30 (4): 483–94.
Treasure, Jonathan. Medline & The Mainstream Manufacture of Misinformation 2006 Stockley, IH. 2002. Stockley's Drug Interactions. 6th ed. London: Pharmaceutical Press.
WHO. 1999. "Radix Ginseng", in, WHO Monographs on Selected Medicinal Plants, Geneva: World Health Organization, 168-182.
Winston, David, Maimes, Steven. 2007. Adaptogens: Herbs for Strength, Stamina, and Stress Relief. Healing Arts Press.
Yun TK, Lee YS, Lee YH, Kim SI, Yun H.Y. 2001. "Anticarcinogenic effect of Panax ginseng C.A. Meyer and identification of active compounds". Journal of Korean Medical Science 16 (S): 6–18.
Guaraná Paullinia cubana Kunth (Sapindaceae)
Planta com sua origem na Amazônia principalmente na Amazônia brasileira e venezuelana. O Guaraná é rico em cafeína.
Molecula da cafeína
Efeitos
Ele é estimulante, diminui a fadiga motora e psíquica, produz ainda maior rapidez e clareza do pensamento, tonifica e coração, e apresenta uma leve ação afrodisíaca, estimulante do apetite, regula o ritmo cardíaco, etc.
A lenda do Guaraná
Os índios Munducurucânia foram os mais prósperos. Venciam as guerras, bons pescadores, e a doença era rara entre eles. Tudo isto por causa de um curumim, que há alguns anos nascera entre eles. Ele era o mais protegido de todos. Na pesca acompanhada por muitos, com ele havia segurança, as piranhas, os jacarés ou qualquer outro perigo não existia. Mas, certo dia, toda a segurança foi embora: O Gênio do Mal apareceu em forma de cascavel e feriu um garoto da tribo. Todos entraram em desespero, mas Tupã, o Deus dos Índios viu toda aquela lamentação e disse: - Tirem os olhos do curumim e plantem-no na terra firme, reguem-no com lágrimas durante 4 luas e ali nascerá a 'Planta da vida," ela dará força aos jovens e revigorará os velhos. Os frutos da nova planta trouxe progresso à tribo, ajudou os velhos e deu mais força aos guerreiros.
BIBLIOGRAFIA
Adriana Basile, Lydia Ferrara, Marisa Del Pezzo, Guido Mele, Sergio Sorbo, Paola Bassi, Domenico Montesano. 2005. Antibacterial and antioxidant activities of ethanol extract from Paullinia cupana Mart. Journal of Ethnopharmacology. 102 (1): 32-36.
C.F. Haskell, D.O. Kennedy, A.L. Milne, K.A. Wesnes, A.B. Scholey. 2006. The acute behavioral effects of guaraná. Appetite. 47 (2): 265.
Caroline S. Weckerle, Michael A. Stutz, Thomas W. Baumann. 2003. Purine alkaloids in Paullinia. Phytochemistry. 64 (3): 735-742.
Charles M. Heard, Sarah Johnson, Gary Moss, Chris P. Thomas. 2006. In vitro transdermal delivery of caffeine, theobromine, theophylline and catechin from extract of Guarana, Paullinia Cupana. International Journal of Pharmaceutics. 317 (1): 26-31.
D.O. Kennedy, C.F. Haskell, B. Robertson, J. Reay, C. Brewster-Maund, J. Luedemann, S. Maggini, M. Ruf, A. Zangara A.B. Scholey. 2008. Improved cognitive performance and mental fatigue following a multi-vitamin and mineral supplement with added guaraná (Paullinia cupana). Appetite. 50 (2-3): 506-513.
D.O. Kennedy, C.F. Haskell, K.A. Wesnes, A.B. Scholey. 2004. Improved cognitive performance in human volunteers following administration of guarana (Paullinia cupana) extract: comparison and interaction with Panax ginseng. Pharmacology Biochemistry and Behavior. 79 (3): 401-411.
H. Fukumasu, J.L. Avanzo, R. Heidor, T.C. Silva, A. Atroch, F.S. Moreno, M.L.Z. Dagli. 2006. Protective effects of guarana (Paullinia cupana Mart. var. Sorbilis) against DEN-induced DNA damage on mouse liver. Food and Chemical Toxicology. 44 (6): 862-867.
Heidge Fukumasu, Tereza Cristina da Silva, José Luis Avanzo, Cyntia Esteves de Lima, Ivone Isabel Mackowiak, André Atroch, Helenice de Souza Spinosa, Fernando Salvador Moreno. 2006. Chemopreventive effects of Paullinia cupana Mart var. sorbilis, the guaraná, on mouse hepatocarcinogenesis. Cancer Letters. 233 (1): 158-164.
Howell G.M. Edwards, Dennis W. Farwell, Luiz F.C. de Oliveira, Jose-Maria Alia, Mireille Le Hyaric, Mauro V. de Ameida. 2005. FT-Raman spectroscopic studies of guarana and some extracts. Analytica Chimica Acta. 532 (2), 177-186.
J. F. de Oliveira, A. S. Ávila, A. C. S. Braga, M. B. N. de Oliveira, E. M. Boasquevisque, R. L. Jales, V. N. Cardoso, M. Bernardo-Filho. 2002. Effect of extract of medicinal plants on the labeling of blood elements with Technetium-99m and on the morphology of red blood cells: a study with Paullinia cupana. Fitoterapia. 73 (4): 305-312.
J.M. Roseland, J.M. Holden, A. Schweitzer, K.W. Andrews, C. Zhao, M. Brandt, J. Woo, J. Dwyer, M.F. Picciano, L.G. Saldanha, J.M. Betz. 2006. Caffeine-Containing Ingredients in Dietary Supplements: Guarana, Kola Nut, Yerba Mate, Tea, and Cocoa. Journal of the American Dietetic Association: 106 (8), Suppl 1, August 2006, Page A43.
R.S. Freitas, S.R.F. Moreno, G.L. Lima-Filho, A.S. Fonseca, M. Bernardo-Filho. 2007. Effect of a commercial extract of Paullinia cupana (guarana) on the binding of 99mTc-DMSA on blood constituents: An in vivo study. Applied Radiation and Isotopes. 65 (5): 528-533.
Renata Rabelo Soriani, Lucilia Cristina Satomi, Terezinha de Jesus A. Pinto. 2005. Effects of ionizing radiation in ginkgo and guaraná. Radiation Physics and Chemistry. 73 (4): 239-242.
S. Aquino, E. Gonçalez, T.A. Reis, I.T. Sabundjian, R.A. Trindade, M.H. Rossi, B. Corrêa, A.L.C.H. Villavicencio. 2007. Effect of γ-irradiation on mycoflora of guarana (Paullinia cupana). Radiation Physics and Chemistry. 76 (8-9), 1470-1473.
Waldecir P. Lima, Luiz C. Carnevali Jr, Robson Eder, Luis Fernando B.P. Costa Rosa, Elfriede M. Bacchi, Marília C.L. Seelaender. 2005. Lipid metabolism in trained rats: Effect of guarana (Paullinia cupana Mart.) supplementation. Clinical Nutrition. 24 (6): 1019-1028.
_________________________________________________________________________________
Ginko biloba (Ginkgoaceae)
Sinonimo Botânico: Pterophyllus salisburiensis, Nelson (1866), Salisburia adiantifolia, Smith (1797).
Nomes popular: Nogueira-of-Japan,-maidenhair tree, or simply ginkgo
É uma planta da terapêutica chinesa há mais de 2800 anos a.C. É considerada sagrada pelos budistas. Apresenta uma forte resistência bacteriana, vírus e radiações, sendo a primeira manifestação de vida ocorrida após a explosão da bomba atômica de Hiroshima.
Utilização terapêutica do Ginko biloba
Melhora o fluxo sanguíneo, atua contra os radicais livres agindo como antioxidante, impedindo a agregação plaquetaria. Na medicina chinesa tradicional, as suas folhas são usadas para combater vários problemas, como asma bronquite, perda da audição, tuberculose, perda da memória, problemas gástricos, ansiedade, etc.
Estudo bioquímico ainda numa fase inicial demonstra que o ginkgolide B é um potente antiplaquetário.
BIBLIOGRAFIA
Abdulaziz A. Al-Yahya, Abdulhakeem A. Al-Majed, A.M. Al-Bekairi, O.A. Al-Shabanah, S. Qureshi. 2006. Studies on the reproductive, cytological and biochemical toxicity of Ginkgo Biloba in Swiss albino mice. Journal of Ethnopharmacology. 107: 222–228.
Andrew S. Granger. 2001. Ginkgo biloba precipitating epileptic seizures. Age and Ageing 30: 523-525.Bikram Singh, Pushpinder Kaur, Gopichand, R.D. Singh, P.S. Ahuja. 2008. Biology and chemistry of Ginkgo biloba. Fitoterapia. 79: 401–418.
ario De Franceschi, Colette Vozenin-Serra. 2000. Origine du Ginko biloba L. Approche phylogénétique Ginko biloba L. origin. Phylogenetical approach. Comptes Rendus de l’Académie des Sciences - Series III - Sciences de la Vie, 323 (6): 583-592.Koch, H. Jaggy, S.S. Chatterjee. 2000. Evidence for immunotoxic e€ects of crude Ginkgo biloba L. leaf extracts using the popliteal lymph node assay in the mouse. International Journal of Immunopharmacology. 22: 229-236.
Elsabagh S, Hartley DE, Ali O, Williamson EM, File Se. 2005. "Differential cognitive effects of Ginkgo biloba after acute and chronic treatment in healthy young volunteers". Psychopharmacology 179 (2): 437–446.
rnst E, Canter PH, Coon JT. 2005. Does ginkgo biloba increase the risk of bleeding? A systematic review of case reports. Perfusion. 18: 52–56.
Fu, Liguo; Li, Nan; Mill, Robert R. 1999. "Ginkgo biloba", in Wu, Z. Y.; Raven, P.H.; Hong, D.Y., Flora of China, 4, Beijing: Science Press; St. Louis: Missouri Botanical Garden Press, pp. 8
G. Baron-Ruppert and N.-P. Luepke. 2001. Evidence for toxic effects of alkylphenols from Ginkgo biloba in the hen’s egg test (HET). Phytomedicine. 8(2): 133–138.
Ganesh Rajaraman, Jie Chen, Thomas K.H. Chang. 2006. Ginkgolide A contributes to the potentiation of acetaminophen toxicity by Ginkgo biloba extract in primary cultures of rat hepatocytes. Toxicology and Applied Pharmacology. 217: 225–233.
Hideto Miwa, Makiko Iijima, Shigeki Tanaka, and Yoshikuni Mizuno. 2008. Generalized Convulsions After Consuming a Large Amount of Gingko Nuts. Epilepsia. 42 (2): 280 – 281.
James J. Collins, Kimberley Evason, Kerry Kornfeld. 2006. Pharmacology of delayed aging and extended lifespan of Caenorhabditis elegans. Experimental Gerontology. 41 (10): 1032-1039.
Jaw-Wen Chen; Yung-Hsiang Chen; Feng-Yan Lin; Yuh-Lien Chen; Shing-Jong Lin. 2003. Ginkgo biloba Extract Inhibits Tumor Necrosis Factor- –Induced Reactive Oxygen Species Generation, Transcription Factor Activation, and Cell Adhesion Molecule Expression in Human Aortic Endothelial Cells. Arteriosclerosis. Thrombosis, and Vascular Biology . 23:1559.
Kelly J. 2002. Toxicity and adverse effects of herbal complementary therapy. Nurse. 17(9): 562-565.
Kinghorn AD. 2002. The role of Pharmacognosy in modern medicine. Expert Opinion on Pharmacotherapy. 3(2): 77-79.
Kupiec T, Raj V. J. 2005. Fatal seizures due to potential herb-drug interactions with Ginkgo biloba. Journal of Analytical Toxicology. 29(7): 755-758.
Kupiec, Thomas, Raj, Vishnu. 2005. CASE REPORT: Fatal Seizures Due to Potential Herb-Drug Interactions with Ginkgo Biloba. Journal of Analytical Toxicology. 29 (7): 755-758.
L Shen, X-Y Chen, X Zhang, Y-Y Li, C-X Fu, Y-X Qiu. 2005. "Genetic variation of Ginkgo biloba L. (Ginkgoaceae) based on cpDNA PCR-RFLPs: inference of glacial refugia". Heredity. 94: 396–401.
L. Witkam and I. Ramzan 2004. "Ginkgo biloba in the treatment of Alzheimer’s disease: A miracle cure?". From Cell to Society. (Conference).
Mahadevan S, Park Y. 2008. "Multifaceted therapeutic benefits of Ginkgo biloba L.: chemistry, efficacy, safety, and uses". Journal of Food Science. 1 (14-9): 73.
Mei Yao, Helen E. Ritchie, Patricia D. Brown-Woodman. 2007. A developmental toxicity-screening test of valerian. Journal of Ethnopharmacology. 113 (2): 204-209.
Murat Cem Miman, Orhan Ozturan, Mustafa Iraz, Tamer Erdem, Ercument Olmez. 2002. Amikacin ototoxicity enhanced by Ginkgo biloba extract (EGb 761). Hearing Research 169: 121-129.
Orestes V. Forlenza. 2003. Ginkgo biloba and memory: myth or reality? Revista de Psiquiatria Clínica. 30 (6): 218-220.
Paul F. Smith, Karyn Maclennan and Cynthia L. Darlington. 1996. The neuroprotective properties of the Ginkgo biloba leaf: a review of the possible relationship to platelet-activating factor (PAF). Journal of Ethnopharmacology. 50 (3): 131-139.
Simpson DP. 1979. Cassell's Latin Dictionary, 5, London: Cassell Ltd., 883.
Smith PF, Maclennan K, Darlington CL. 1996. "The neuroprotective properties of the Ginkgo biloba leaf: a review of the possible relationship to platelet-activating factor (PAF)". Journal of Ethnopharmacology 50 (3): 131–139.
Whetstone, R. David. 2006. "Ginkgo biloba", in Flora of North America Editorial Committee, eds. 1993+, Flora of North America, 2, New York & Oxford: Oxford University Press
Xuemin Jiang. 2005. Effect of ginkgo and ginger on the pharmacokinetics and pharmacodynamics of warfarin in healthy subjects. British Journal of Clinical Pharmacology. 59 (4): 425–432.
Zhiyan Zhou and Shaolin Zheng. 2003. "Palaeobiology: The missing link in Ginkgo evolution". Nature. 423 (423): 821–822.
Winter, E., 1991. Effects of an extract of Ginkgo biloba on learning and memory in mice. Pharmacology, biochemistry and behavior. 38 (1): 109-114.
__________________________________________________________________________________
CATUABA
Erythroxylum catuaba e Erythroxylum coca DC (Erythroxylaceae)
A catuaba tem uma longa história de uso medicinal natural como afrodisíaco. Os índios Tupis do Brasil foram os primeiros a descobrir as qualidades afrodisíacas da planta e nos últimos séculos inventaram muitas canções sobre as suas qualidades e funções.
Uma infusão da raiz é usada na medicina tradicional brasileira como afrodisíaco e estimulante do Sistema Nervoso Central. Uma decocção da raiz é comummente usada para a impotência, agitação, nervosismo, nevralgia e cansaço, problemas de memória e fraqueza sexual.
Erythroxylum é um género botânico pertencente à família Erythroxylaceae. São aproximadamente 250 espécies, incluindo-se a espécie Erythroxylum coca onde extrai-se a droga cocaína e o chá de coca. Da Erythroxylum catuaba extrai-se um pretenso afrodisíaco chamado catuaba e, a Erytroxylum novogranatensis é utilizada em refrigerantes do tipo "Coca".
CLINICAMENTE
Manabe et al., (1992) estudaram o efeito do extrato da catuaba em infecções de pacientes com AIDS. Os seus dados indicaram que o extrato apresenta uma ação contra as infecções oportunistas em pacientes com esta síndrome.
USO
O catuaba afrodisíaco. Estimula o desejo sexual e aumenta a libido tanto no homem como na mulher. Estimula o fluxo sanguíneo aos órgãos genitais, pode fortificar e prolongar uma ereção aumenta a excitação sexual e dá orgasmos mais fortes. Pouco após a ingestão, a maioria das pessoas sentirá formigueiros ao longo da coluna e um aumento da sensualidade pelo corpo inteiro.
A pele e os órgãos genitais tornam-se mais sensíveis. É uma erva que dá à tua vida amorosa um impulso especial. No Brasil a catuaba também é usada para equilibrar e acalmar o Sistema Nervoso Central. Uma infusão da raiz é usada na medicina tradicional brasileira como afrodisíacco e estimulante do sistema nervoso central. Uma decoção da raiz é comummente usada para a impotência, agitação, nervosismo, nevralgia e cansaço, problemas de memória e fraqueza sexual.
Em geral, no Brasil aplicam-se uma infusão normal (chá da raiz) e uma tintura de álcool. O uso recomendado é 1-3 chávenas de infusão diariamente, 0,2-3 mL de uma tintura de álcool normal duas vezes ao dia.
QUÍMICA
Na catuaba, crê-se que um grupo de três alcalóides chamados catuabina A, B e C aumentam a função sexual estimulando o sistema nervoso. Na medicina popular a catuaba ou catubina é o Viagra® natural.
BIBLIOGRAFIA
Abidi, S.L. 2001. Chromatographic analysis of plant sterols in foods and vegetable oils. Journal of Chromatography A. 935: 173-201.
Antunes, E.; Gordo, W.M.; de Oliveira, J.F.; Teixeira, C.E.; Hyslop, S.; de Nucci, G., 2001. The relaxation of isolated rabbit corpus cavernosum by the herbal medicine Catuama® and its constituents. Phytotherapy Research, 15, 416-42,
ANVISA Agencia Nacional de Vigilância Sanitária. 2004. Guia para validação de Análisis de productos fitoterapéuticos comerciales de “catuaba” por LC-UV-MS. Noticias Técnicas del Laboratorio. 3: 14-16.
Barbosa, N.R.; Fischmann, L.; Talib, L.L.; Gattaz, W.F. 2004. Inhibition of plateletphospholipase A2 activity by catuaba extract suggests anti-inflammatory properties. Phytotherapy Research 18: 942-944.
Beltrame, F. L.; Cass, Q. B.; Vieira, P.C.; Ferreira, A.G.; Tavares, L.A.Berlyn, G. P.; Miksche, J. P. Botanical microtechnique and cytochemistry. Eames: Iowa State University, 1976, 326p.
Bouic, P. J. D.; Lamprecht, J. H. 1999.Plant sterol and sterolins: A review of their immune-modulating properties. Alternative Medicine Review. 4 (3): 170-177,
Calixto, J.B. 2005. Twenty-five years of research on medicinal plants in Latin America - Apersonal view. Journal of Ethnopharmacology. 100: 131-134,
Calixto, J.B., Cabrini, D.A. 1997. Herbal Catuama induces endotheliumdependent andindependent vasorelaxation action on isolated vesselsfrom rats, guinea-pigs and rabbits. Phytotherapy Research, 1132-1138.
Campos, M.M.; Fernandes, E.S.; Ferreira, J.; Santos, A.R.S.; Calixto, J.B. 2005. Antidepressant-like effects of Trichilia catigua (Catuaba) extract: evidence for dopaminergic-mediated mechanisms. Psypharmacology. 182 (1): 45-53.
Deyse Valverde G. De Andrade, Diêgo Madureira de Oliveria, George Barreto, Laura-Aon Bertolino, Ezequiel Saraceno, Francisco Capani, Lisandro Diego Giraldez. 2008. Effects of the extract of Anemopaegma mirandum (Catuaba) on Rotenone-induced apoptosis in human neuroblastomas SH-SY5Y cells. Brain Research. 1198: 188-196.
Flávio Luís Beltrame, Edson Rodrigues Filho, Fabio A. Proença Barros, Diógenes AparícioGarcia Cortez, Quezia Bezerra Cass. 2006. A validated higher-performance liquid chromatography method for quantification of cinchonain Ib in bark and phytopharmaceuticals of Trichilia catigua used as Catuaba. Journal of Chromatography A, 1119 (1-2): 257-263.
__________________________________________________________________________________
BRAHMI
Bacopa monnieri (L.) Pennell (Scrophulariaceae)
Comumente cresce em toda a Índia em áreas alagadas, Nepal, Sri Lanka, China, Taiwan e Vietnã, e também é encontrado no sul da Flórida e outros estados do EUA onde pode ser cultivado em condições de umidade em jardim.
USO MEDICINAL
Esta planta possui um grande número de utilizações na Ayurveda. É um tradicional remédio para o tratamento para a epilepsia. Estudos em ratos indicam que o extrato da planta melhora a capacidade da memória e a aprendizagem, e aumenta habilidade motora. Estudos em humanos demonstraram que o extrato da planta tem efeitos ansioliticos.
Ela está listada como um nootrópico, uma droga que aumenta a capacidade cognitiva. Esta planta também tem sido utilizada tradicionalmente para benzer recém-nascidos na convicção de que irá abrir o portão de inteligência. Estudos recentes sugerem que Bacopa melhora a atividade intelectual. Possui propriedades antioxidantes, reduz a oxidação da gordura no sangue.
Bacopa monnieri Ayurveda é uma planta medicinal usada na Índia para a memória, epilepsia, e como um sedativo leve. Bacopa comumente cresce em áreas em toda a Índia. Estudos mostram que Bacopa tem fortes propriedades antioxidantes, protege função mental em pessoas com epilepsia que usam fenitoina, enquanto um estudo em ratos mostrou melhora na memória e habilidade na aprendizagem.
Erva da Memória
Investigador no Departamento de Psicologia, Universidade de Wollongong, na Austrália, estudou os efeitos de Bacopa sobre memória humana. Setenta e seis adultos com idades entre 40 e 65 anos participaram de um estudo duplo-cego randomizado, em que várias funções de memória foram testadas e avaliadas os níveis de ansiedade. Houve três sessões de ensaio: antes do julgamento, uma após três meses, sobre o julgamento, e umas seis semanas após a conclusão do tratamento. Os resultados mostraram um significativo efeito de Bacopa monniera em um teste para a retenção de informações novas. Testes Follow-up (seguimento) mostraram que o ritmo de aprendizagem não foi afetado, o que sugere que Bacopa diminui a taxa de esquecimento de informação recém-adquirida.
BENEFÍCIOS ADICIONAIS DE
Bacopa moniera tem propriedades antioxidantes. Estudos em roedores indicaram que Bacopa tem a função de ajudar a proteger a úlcera de estômago em formação.
BIBLIOGRAFIA
Bhattacharya S.K, Bhattacharya A, Kumar A, Ghosal S. 2000a. Antioxidant activity of Bacopa monniera in rat frontal cortex, striatum and hippocampus. Phytotherapy Research 14: 174–179.
Chakravarty AK, Garai S, Masuda K, Nakane T, Kawahara N. 2003. Bacopasides III-V: three new triterpenoid glycosides from Bacopa monniera. Chemical pharmaceutical bulletin. 51(2): 215-217. (Tokyo).
Channa S, Dar A, Yaqoob M, Anjum S, Sultani Z, Atta-ur-Rahman. 2003. Broncho-vasodilatory activity of fractions and pure constituents isolated from Bacopa monniera. Journal of Ethnopharmacology. 86 (1): 27-35.Channa S, Dar A, Yaqoob M, Anjum S, Sultani Z, Atta-ur-Rahman. 2003. Broncho-vasodilatory activity of fractions and pure constituents isolated from Bacopa monniera. Journal of Ethnopharmacology. 86(1): 27-35.
Chaudhuri PK, Srivastava R, Kumar S, Kumar S. 2004. Phytotoxic and antimicrobial constituents of Bacopa monnieri and Holmskioldia sanguinea. Phytotherapy Research.18 (2): 114-117.
howdhuri DK, Parmar D, Kakkar P, Shukla R, Seth PK, Srimal RC. 2002. Antistress effects of bacosides of Bacopa monnieri. Phytotherapy Research. 16(7): 639-45.Chowdhuri DK, Parmar D, Kakkar P, Shukla R, Seth PK, Srimal RC. 2002. Antistress effects of bacosides of Bacopa monnieri: modulation of Hsp70 expression, superoxide dismutase and cytochrome P450 activity in rat brain. Phytotherapy research. 16(7): 639-645.
Deepak M, Sangli GK, Arun PC, Amit A. 2005. Quantitative determination of the major saponin mixture bacoside A in Bacopa monnieri by HPLC. Phytochemical Analysis. 16(1): 24-29.
Deepak Rai, Gitika Bhatia, Gautam Palit, Raghwendra Pal, Satyawan Singh, Hemant K. Singh. 2003. Adaptogenic effect of Bacopa monniera (Brahmi). Pharmacology Biochemistry and Behavior. 75 (4): 823-830.
Dorababu M, Prabha T, Priyambada S, Agrawal VK, Aryya NC, Goel RK. 2004. Effect of Bacopa monniera and Azadirachta indica on gastric ulceration and healing in experimental NIDDM rats. Indian Journal of Experimental Biology. 42(4): 389-97.
Goel RK, Sairam K, Babu MD, Tavares IA, Raman A. 2003. In vitro evaluation of Bacopa monniera on anti-Helicobacter pylori activity and accumulation of prostaglandins. Phytomedicine. 10(6-7): 523-527.
Goel RK, Sairam K, Babu MD, Tavares IA, Raman A. 2003. In vitro evaluation of Bacopa monniera on anti-Helicobacter pylori activity and accumulation of prostaglandins. Phytomedicine.10 (6-7): 523-7.
Miranda CL, Stevens JF, Helmrich A, Henderson MC, Rodriguez RJ, Yang YH, Deinzer ML, Barnes DW, Buhler DR.Nathan PJ, Clarke J, Lloyd J, Hutchison CW, Downey L, Stough C. 2001. The acute effects of an extract of Bacopa monniera (Brahmi) on cognitive function in healthy normal subjects. Hum Psychopharmacology. 16(4): 345-351.
Nikolic D, Li Y, Chadwick LR, Grubjesic S, Schwab P, Metz P, van Breemen RB. 2004. Metabolism of 8-prenylnaringenin, a potent phytoestrogen from hops (Humulus lupulus), by human liver microsomes. Drug Metabolism and Disposition. 32(2): 272-279.
ai D, Bhatia G, Palit G, Pal R, Singh S, Singh HK. 2003. Adaptogenic effect of Bacopa monniera (Brahmi). Pharmacology, Biochemistry, and Behavior. 75(4): 823-830.
Russo A, Izzo AA, Borrelli F, Renis M, Vanella A. 2003. Free radical scavenging capacity and protective effect of Bacopa monniera L. on DNA damage. Phytotherapy research.17 (8): 870-875.
S Roodenrys, D Booth, S Bulzomi, A Phipps, C 2002. Chronic effects of Brahmi (Bacopa monnieri) on human memory. Neuropsychopharmacology. 27(2): 279-2781.
S Roodenrys, D Booth, S Bulzomi, A Phipps, C. 2002. Chronic effects of Brahmi Bacopa monnieri) on human memory. Neuropsychopharmacology. 27 (2): 279-281.
S Roodenrys, D Booth, S Bulzomi, A Phipps, C.2002. Chronic effects of Brahmi (Bacopa monnieri) on human memory. Neuropsychopharmacology. 27(2): 279-81.
Sairam K, Dorababu M, Goel RK, Bhattacharya SK. 2002. Antidepressant activity of standardized extract of Bacopa monniera in experimental models of depression in rats. Phytomedicine. 9(3): 207-211.
Stough C, Lloyd J, Clarke J, Downey LA, Hutchison CW, Rodgers T, Nathan PJ. 2001. Psychopharmacology.156 (4): 481-484.
Das A, Shanker G, Nath C, Pal R, Singh S, Singh, H. 2002. A comparative study in rodents of standardized extracts of Bacopa monniera and Ginkgo biloba: anticholinesterase and cognitive enhancing activities. Pharmacology, Biochemistry and Behavior 73: 893–900.
__________________________________________________________________________________
Ginseng indiano
Withania somnifera (L.) Dunal (Solanaceae)
Withania somnifera, Também conhecido como Ashwagandha, ginseng indiano, Winter cereja, Ajagandha, Kanaje hindi e Samm Al Ferakh, é uma planta da Família das Solanaceae.
Uso Medicinal
Em ashwaganda Ayurveda é considerada uma erva Rasayana, que trabalha em uma base inespecífica para aumentar a longevidade e a saúde. Esta erva é também considerada um adaptógeno atóxico, que é uma erva que funciona em uma base para normalizar função fisiológica inespecíficos, e do sistema neuroendócrino. As raízes e bagas desta plantas são usadas na medicina popular.
Em Ayurveda, as raízes frescas são, por vezes, cozido em leite, antes da secagem, a fim de aliviar os componentes indesejáveis do corpo. Ashwagandha em sânscrito significa "cheiro do cavalo", provavelmente proveniente do odor da sua raiz que lembra a do cavalo suado. A espécie de nome somnifera significa "tornar-sono", em latim, indicando que a ele são atribuídas propriedades sedativas, mas tem sido usada para melhorar a vitalidade sexual, e como um adaptógeno.
BIBLIOGRAFIA
Amr Amin, Alaa Hamza. 2008. The protective effect of a purified extract of Withania somnifera against doxorubicin-induced cardiac toxicity in rats. Heart, Lung and Circulation. 17 (1): S4-S5.
Bhaskara Reddy Madina, Lokendra Kumar Sharma, Pankaj Chaturvedi, Rajender Singh Sangwan, Rakesh Tuli. 2007. Purification and characterization of a novel glucosyltransferase specific to 27β-hydroxy steroidal lactones from Withania somnifera and its role in stress responses. Biochimica et Biophysica Acta (BBA) - Proteins & Proteomics. 1774 (9): 1199-1207.
Bhattacharya S.K, Bhattacharya A, Sairam K, Ghosal S. 2000b. Anxiolytic-antidepressant activity of Withania somnifera glycowithanolides: an experimental study. Phytomedicine 7: 463–469.
Bhattacharya S.K, Muruganandam A.V. 2003. Adaptogenic activity of Withania somnifera: an experimental study using a rat model of chronic stress. Pharmacology, Biochemistry and Behavior 75: 547–555.
C. Abdul Jaleel, G.M.A. Lakshmanan, M. Gomathinayagam, R. Panneerselvam. 2008. Triadimefon induced salt stress tolerance in Withania somnifera and its relationship to antioxidant defense system. South African Journal of Botany. 74 (1): 126-132.
C. Abdul Jaleel, R. Gopi, P. Manivannan, R. Panneerselvam. 2008. Exogenous application of triadimefon affects the antioxidant defense system of Withania somnifera Dunal. Pesticide Biochemistry and Physiology. 91 (3): 170-174.
D. Martín-Herrera, S. Abdala, D. Benjumea, J. Gutiérrez-Luis. 2008. Diuretic activity of some Withania aristata Ait. Fractions. Journal of Ethnopharmacology. 117 (3): 496-499.
D. Martín-Herrera, S. Abdala, D. Benjumea, P. Pérez-Paz. 2007. Diuretic activity of Withania aristata: An endemic Canary Island species. Journal of Ethnopharmacology. 113 (3): 487-491.
Dhuley J.N. 2001. Nootropic-like effect of ashwagandha (Withania somnifera L) in mice. Phytotherapy Research 15: 524–528.
Gupta S.K, Dua A, Vohra B.P. 2003a. Withania somnifera (Ashwagandha) attenuates antioxidant defense in aged spinal cord and inhibits copper induced lipid peroxidation and protein oxidative modifications. Drug Metabolism and Drug Interactions 19: 211–222.
Ichikawa H, Takada Y, Shishodia S, Jayaprakasam B, Nair MG, Aggarwal BB. 2006. Withanolides potentiate apoptosis, inhibit invasion, and abolish osteoclastogenesis through suppression of nuclear factor-kappaB (NF-kappaB) activation and NF-kappaB-regulated gene expression. Mol Cancer Ther, 5(6): 1434-45
Ipseeta Ray Mohanty, Dharamvir Singh Arya, Suresh Kumar Gupta. 2008. Withania somnifera provides cardioprotection and attenuates ischemia–reperfusion induced apoptosis. Clinical Nutrition. 27 (4): 635-642.
Laxminarain Misra, Payare Lal, Narayan D. Chaurasia, Rajender S. Sangwan, Sudhir Sinha, Rakesh Tuli. 2008. Selective reactivity of 2-mercaptoethanol with 5β,6β-epoxide in steroids from Withania somnifera. Steroids. 73 (3): 245-251.
Laxminarain Misra, Priyanka Mishra, Archana Pandey, Rajender S. Sangwan, Neelam S. Sangwan, Rakesh Tuli. 2008. Withanolides from Withania somnifera roots. Phytochemistry. 69 (4): 1000-1004.
Modhumita Ghosh. 2008. Purification of a lectin-like antifungal protein from the medicinal herb, Withania somnifera. Fitoterapia, Fitoterapia. 80(2): 91-5.
P.C. Mali, P.S. Chouhan, R. Chaudhary. 2008. Evaluation of antifertility activity of Withania somnifera in male albino rats. Fertility and Sterility. 90 (1): S18.
S.K. Kulkarni, Ashish Dhir. 2008. Withania somnifera: An Indian ginseng. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 32 (5): 1093-1105.
Serida Khatun, Mohammad Babar Ali, Eun-Joo Hahn, Kee-Yoeup Paek. 2008. Copper toxicity in Withania somnifera: Growth and antioxidant enzymes responses of in vitro grown plants. Environmental and Experimental Botany. 64 (3): 279-285.
Ya-ming Xu, Marilyn T. Marron, Emily Seddon, Steven P. McLaughlin, Dennis T. Ray, Luke Whitesell, A.A. Leslie Gunatilaka. 2009. 2,3-Dihydrowithaferin A-3β-O-sulfate, a new potential prodrug of withaferin A from aeroponically grown Withania somnifera. Bioorganic & Medicinal Chemistry. 17 (6): 2210-2214
__________________________________________________________________________________
Unha-de-gato
ERA
Ficus pumila (Moraceae)
A espécie Ficus pumila é nativa da China, Japão e Formosa, e foi largamente difundida por todo o mundo devido ao seu aspecto ornamental. Para esta espécie os casos de intoxicações relatados na literatura estão restritos ao contato do látex com a pele ou uso tópico do mesmo no tratamento de verrugas (Massmanian, 1995).
Esta aplicação do látex traz graves conseqüências para a pele, caracterizadas por ulceração intensa. Um caso foi relatado onde a vítima era uma criança de nove meses de idade. Ela ingeriu parte de uma folha da planta, e reagiu imediatamente à presença da folha na boca chorando e com salivação abundante. O exame mostrou leve irritação na mucosa oral, sem maiores complicações.
BIBLIOGRAFIA
Alziro de Amorin, Helcio R. Borba, Jorge P. P. Carauta, Daíse Lopes, Maria A. C. Kaplan. 1999. Anthelmintic activity of the latex of Ficus species. Journal of Ethnopharmacology, 64 (3): 255-258.
Cheng Ning Abraham Leong, Masakuni Tako, Isao Hanashiro, Hajime Tamaki. 2008. Antioxidant flavonoid glycosides from the leaves of Ficus pumila L. Food Chemistry. 109 (2): 415-420.
J K Francis. 2004. Tropical ecosystems - Ficus spp. (and other important Moraceae). Encyclopedia of Forest Sciences. 1699 -1704.
Luisa Pistelli, Elisabetta E. Chiellini, Ivano Morelli. 2000. Flavonoids from Ficus pumila. Biochemical Systematics and Ecology. 28 (3): 287-289.
Nana K. Ayisi, Caesar Nyadedzor. 2003. Comparative in vitro effects of AZT and extracts of Ocimum gratissimum, Ficus polita, Clausena anisata, Alchornea cordifolia, and Elaeophorbia drupifera against HIV-1 and HIV-2 infections. Antiviral Research. 58(1): 25-33.
Perelló, M, Arribére, M.C, Caffini, N.O, Priolo, N.S. 2000. Proteolytic enzimes from latex of Ficus pumila L. (Moraceae). Acta Farmaceutica Bonaerense 19(4): 257-262.
Pistelli L, Chiellini E. E, Morelli I. 2000. Flavonoids from Ficus pumila. Biochemical Systematics and Ecology 28: 287-289.
__________________________________________________________________________________
NÓ-DE-CACHORRO
Heteropterys aphrodisiaca O. Mach. (Malpighiaceae)
A planta nó-de-cachorro (Heteropteris afrodisíaca) é um arbusto com cerca de um metro de altura, encontrado nos cerrados do Mato Grosso e de Goiás. A raiz, que tem semelhança anatômica com um pênis de cachorro (daí vem o nome popular da planta), tem efeito revigorante. A mistura da planta com pinga. É ingerida pelos homens da região como estimulante sexual. É também conhecida como nó-de-porco, guaco, jasmim-amarelo, resedá-amarelo e tintureiro.
Embora a nomenclatura em latim (o nome científico) indique a relação da planta com o desempenho sexual (afrodisíaca), os pesquisadores afirmam que ainda não há comprovação de que atue nas funções sexuais diretamente, a planta atua com um revigorante para o organismo em geral, sendo recomendada especialmente para pessoas idosas.
"A folha tem propriedades terapêuticas que ajudam a regularizar as funções do organismo como um todo, e, por conseguinte, a função sexual",
O nó-de-cachorro possui uma ação antioxidante que reduz a quantidade de radicais livres, responsáveis por alguns sinais de envelhecimento, como o surgimento de rugas.
BIBLIOGRAFIA
Galvao, S.M., Marques, L.C., Oliveira, M.G., Carlini, E.A., 2002. Heteropterys aphrodisiaca (extract BST0298): a Brazilian plant that improves memory in aged rats. Journal of Ethnophamacology 79: 305–311.
Fernando L. Melo, Fabricio J. Benati, Walter Antonio Roman Junior, João Carlos Palazzo de Mello, Carlos Nozawa, Rosa Elisa Carvalho Linhares. 2008. The in vitro antiviral activity of an aliphatic nitro compound from Heteropteris aphrodisiaca. Microbiological Research. 163 (2): 136-139.
S. M. P. Galvão, L. C. Marques, M. G. M. Oliveira, E. A. Carlini. 2002. Heteropterys aphrodisiaca (extract BST0298): a Brazilian plant that improves memory in aged rats. Journal of Ethnopharmacology. 79 (3): 305-311.
__________________________________________________________________________________
GUINÉ
Petiveria alliacea L. (Phytolaccaceae)
INDICAÇÃO
Dor reumática, da coluna, muscular e cabeça, fortalece a gengiva e a garganta, ajuda em casos de inchaço, inflamação na boca e falta de memória.
USOS MEDICINAIS
Petiveria alliacea tem sido amplamente utilizada para tratar uma surpreendente variedade de condições médicas tanto em humanos como em animais, incluindo: doenças venéreas, um anti-séptico, artrite, dor, cancro, inflamações do ventre, diurético, de coagulante, frio, mordida de cobra, gripe, histeria, paralisia, febre, raiva, e para mordida de morcego, repelente de insetos e como um abortivo.
USOS E EFICÁCIA
Na República Dominicana, as raízes da Petiveria alliacea são usadas em tratamentos contra os parasitos internos, e na pecuária como um repelente de insetos. Não foram estudadas as propriedades antiparasitárias de P. alliacea na pecuária. Além disso, extratos com hexano da planta mostraram alguma atividade contra o protozoário Trypanosoma cruzi no sangue in vitro. Estudos têm mostrado que o extrato bruto etanólico apresenta alguma atividade repelente contra Boophilus microplus. Dibenzyltrisulfide, um dos compostos nas raízes de P. alliacea, é inseticida (Cylas formicarius elegantulus e Hypothenemus hampei). Em outros estudos, extratos de P. Alliaceae: forneceu alguma proteção contra infecções por Listeria monocytogenes em camundongos, inibiu a inflamação na pata induzindo edema em camundongos, e reduziu agregação plaquetaria in vitro.
BIBLIOGRAFIA
Asmus, R.M.F. and Ferraz, S. 1988. Antagonistic effects of some plant species, mainly legumes, on Meloidogyne javanica. Fitopatologia Brasileira. 13 (1): 20-24.
Ayala, J.R., Cruz, A.M., Miranda, Z. 1994. Effects of the aqueous extract of Canavalia ensiformis, Bursera graveolens, Petiveria alliacea, and Parthenium hysterophorus on sorghum germination. Technical note. Cuban Trypanosoma cruzi. Journal of Ethnopharmacology. 62 (2): 107-115.
Caceres, A., B. Lopez, S. Gonzalez, I. Berger, I. Tada, and J. Maki. 1998. Plants used in Guatemala for the treatment of protozoal infections. I. screening of activity to bacteria, fungi and American trypanosomes of 13 native plants. Journal of Ethnopharmacology. 62(3): 195-202.
Carrillo, C.M., Chinchilla, E.A., Gonzalez, L.A., Toledo, R.A., and Zambrana, H.G. 1997. The prevention of fowl cholera, with aqueous extracts of plants, in poultry production. Agronomia Mesoamericana. 8(2): 152-158. (Spanish)
Elisabetsky, E. and Castilhos, Z.C. 1990. Plants used as analgesics by Amazonian Caboclos as a basis for selecting plants for investigation. International Journal of Crude Drug Research. 28 (4): 309-320.
Franco Delle Monache, Luis Enrique Cuca Suarez. 1992. 6-C-formyl and 6-C-hydroxymethyl flavanones from Petiveria alliacea. Phytochemistry. 31(7): 2481-2482.
Germano, D.H.P., Caldeira, T.T.O., Mazella, A.A.G., Sertie, J.A.A., and Bacchi, E.M. 1993. Topical anti-inflammatory activity and toxicity of Petiveria alliacea. Fitoterapia. 64 (5): 459-462.
Germano, D.H.P., Sertie, J.A.A., Bacchi, E.M. 1995. Pharmacological assay of Petiveria alliacea. II: Oral anti-inflammatory activity and gastrotoxicity of a hydroalcoholic root extract. Fitoterapia. 66(3): 195-202.
Giron, L.M., Freire, V., Alonzo, A., and Caceres, A. 1991. Ethnobotanical survey of the medicinal flora used by the Caribs of Guatemala. Journal of Ethnopharmacology. 34(2-3): 173-187.
Guerra, M. de O., Maia, J.G.S., Peters, V.M., and Cabral, J.A. daS. 1988. Screening of Amazon native plants with a potential for inhibiting fertilization in rats. Acta Amazonica (Suplement). 18(1-2): 129-134. (Portuguese)
Johnson, L., Williams, L.A.D. and Roberts, E.V. 1997. An insecticidal and acaricidal polysulfide metabolite from the roots of Petiveria alliacea. Pesticide Science. 50(3): 228-232.
Jose R. De Sousa, Antonio J. Demuner, Jose A. Pinheiro, Eberhard Breitmaier, Bruce K. Cassels. 1990. Dibenzyl trisulphide and trans-N-methyl-4-methoxyproline from Petiveria alliacea. Phytochemistry. 29 (11): 3653-3655.
L. Jovicevic, M. P. Troiani, A. Capezzone de Joannon, L. Saso, G. Mezzanti, V. Rossi. 1993. In Vitro Antiproliferative Activity of Petiveria Alliacea L. on Several Tumor Cell Lines. Pharmacological Research. 27 (1): 105-106.
Luz Stella Hoyos, William W. Au, Moon Y. Heo, Debra L. Morris, Marvin S. Legator. 1992. Evaluation of the genotoxic effects of a folk medicine, Petiveria alliacea (Anamu). Mutation Research/Genetic Toxicology. 280 (1): 29-34.
M.R. Duarte, J.F. Lopes. 2005. Leaf and stem morphoanatomy of Petiveria alliacea. Fitoterapia. 76 (7-8): 599-607.
Malpezzi, E.L.A., Davino, S.C., Costa, L.V., Freitas, J.C., Giesbrecht, A.M. and Roque, N.F. 1994. Antimitotic action of extracts of Petiveria alliacea on sea urchin egg development. Brazilian Journal of Medical and Biological Research. 27(3): 749-754.
Mansingh, A. and L.A.D. Williams. 1998. Pesticidal potential of tropical plants - II. Acaricidal activity of crude extracts of several Jamaican plants. Insect Science and its Application. 18(2): 149-155.
Monache, F. delle and Suarez, L.E.C. 1992. 6-C-Formyl and 6-C-hydroxymethyl flavanones from Petiveria alliacea [leaves]. Phytochemistry. 31(7): 2481-2482.
Odeyemi, O. 1993. Insecticidal properties of certain indigenous plant oils against Sitophilus zeamais Mots. Applied Entomology and Phytopathology. 60 (1:2): 19-27.
Olaifa, J.I. and Akingbohungbe, A.E. 1987. Antifeedant and insecticidal effects of extracts of Azadirachta indica, Petiveria alliacea and Piper guineense on the variegated grasshopper. Zonocerus variegatus. :405-418.
Olaifa, J.I., Erhun, W.O., and Akingbohungbe, A.E. 1987. Insecticidal activity of some Nigerian plants. Insect Science and its Application. 8(2): 221-224.
Oluwole, F.S. and Bolarinwa, A.F. 1998. The uterine contractile effect of Petiveria alliacea seeds. Fitoterapia. 69(1): 3-6.
Patrícia B. Gomes, Emmanuelle C. Noronha, Carla Thiciane V. de Melo, José N.S. Bezerra, Manoel A. Neto, Cleide S. Lino, Silvânia M.M. Vasconcelos, Glauce S.B. Viana, Francisca Cléa. 2008. Central effects of isolated fractions from the root of Petiveria alliacea L. (tipi) in mice. Journal of Ethnopharmacology. 120 (2): 209-214.
Paulo José Coelho Benevides, Maria Claudia M. Young, Astréa M. Giesbrecht, Nídia F. Roque, Vanderlan da S. Bolzani. 2001. Antifungal polysulphides from Petiveria alliacea L. Phytochemistry. 57 (5): 743-747.
Ponte, J.J. da, A. Franco, and J. Silveira Filho. 1996. Preliminary investigation on the nematicide potential of Guine's plants (Petiveria alliacea). Fitopatologia Venezolana. 9(1): 14-15.
Ponte, J.J. da, Franco, A., and Menezes, R.N. 1980. Preliminary report on the potentiality of "tipi" (Petiveria alliacea) as nematicide. Fitopatologia Brasileira. 5(3): 440-441. (Portuguese)
Quadros, M.R., A.R.M. Souza Brito, and M.L.S. Queiroz. 1999. Petiveria alliacea L. extract protects mice against Listeria monocytogenes infection - effects on bone marrow progenitor cells. Immunopharmacology and Immunotoxicology. 21 (1): 109-124.
R.A.B. Lopes-Martins, D.H. Pegoraro, R. Woisky, S.C. Penna, J.A.A. Sertié. 2002. The anti-Inflammatory and analgesic effects of a crude extract of Petiveria alliacea L. (Phytolaccaceae). Phytomedicine. 9 (3): 245-248.
Roman Kubec, Rabi A. Musah. 2001. Cysteine sulfoxide derivatives in Petiveria alliacea. Phytochemistry. 58 (6): 981-985.
Roman Kubec, Rabi A. Musah. 2005. γ-Glutamyl dipeptides in Petiveria alliacea. Phytochemistry. 66 (20): 2494-2497.
Roman Kubec, Seokwon Kim, Rabi A. Musah. 2002. S-Substituted cysteine derivatives and thiosulfinate formation in Petiveria alliacea—part II. Phytochemistry. 61 (6): 675-680.
Roman Kubec, Seokwon Kim, Rabi A. Musah. 2003. The lachrymatory principle of Petiveria alliacea. Phytochemistry. 63 (1): 37-40.
Ruiz, A. 1972. Clinical, morphological, histochemical and clinical pathological studies of anamu (Petiveria alliacea) poisoning in cattle. Dissertation Abstracts International. 33B(1): 490.
S. Marini, L. Jovicevic, C. Milanese, B. Giardina, L. Tentori, M. G. Leone, V. Rossi. 1993. Effects of Petiveria Alliacea L. on Cytokine Production and Natural Killer Cell Activity. Pharmacological Research. 27 (1): 107-108.
Sabori, I., Cabrera, M., Lopez, C., and Muina, M. 1992. Identification of the shade plants, green cover plants and weeds susceptible to root-knot nematodes. Revista Baracoa. 22(1): 21-28. (Spanish)
Seokwon Kim, Roman Kubec, Rabi A. Musah. 2006. Antibacterial and antifungal activity of sulfur-containing compounds from Petiveria alliacea L. Journal of Ethnopharmacology. 104 (1-2): 188 -192.
Sousa-J-R-de. Demuner-A-J. Pinheiro-J-A. Breitmaier-E. Cassels-B-K. 1990. Dibenzyl trisulphide and trans-n-methyl-4-methoxyproline from Petiveria alliacea. Phytochemistry. 29(11): 3653-3655.
Souza, Brito A.R.M. and Souza, Brito A.A. 1993. Forty years of Brazilian medicinal plant research. Journal of Ethnopharmacology. 39 (1): 53-67.
Trheebilcock, P.E., Villafane, A.F., Gil, P.A. 1978. Nitrate poisoning in cattle. Revista Instituto Colombiano Agropecuario. 13 (1): 119-125. (Spanish)
V. Rossi, S. Marini, L. Jovicevic, S. D'Atri, M. Turri, B. Giardina. 1993. Effects of Petiveria Alliacea L. on Cell Immunity. Pharmacological Research. 27 (1): 111-112.
Villar, R., Calleja, J.M., Morales, C., and Caceres, A. 1997. Screening of 17 Guatemalan medicinal plants for platelet antiaggregant activity. Phytotherapy Research. 11(6): 441-445.
Williams, L.A.D., T.L. The, M.T. Gardner, C.K. Fletcher, A. Naravane, N. Gibbs, and R. Fleishhacker. 1997. Immunomodulatory activities of Petiveria alliacea L. Phytotherapy Research. 11(3): 251-253.
_________________________________________________________________________________
CARQUEJA
Baccharis trimera (Less) DC (Asteraceae)
A carqueja (Baccharis trimera (Less)) DC; Asteraceae) é uma planta ideal para canteiros de jardins, pois cresce formando tufos espessos. Pelo seu gosto amargo, a medicina popular recomenda seu uso para combater problemas digestivos e hepáticos. Com efeito, diurético, auxilia no emagrecimento e no
controle da diabete. Pelo mesmo motivo, deve ser usada com moderação. Nome científico: Baccharis trimera (Less.) DC. Família: Asteraceae.
Sinônimo botânico: Baccharis genisteiloides var. Trimera (Less.). Baker. Baccharis trimera Person, (=Molina trimera Less.). Outros nomes populares: bacanta, bacárida, cacaia-amarga, cacália-amarga, cacália-amargosa, caclia-doce, cuchi-cuchi, carque, carqueja-amarga, carqueja-amargosa, carqueja-do-mato, carquejinha, condamina, Iguape, quina-de-condomiana, quinsu-cucho, tiririca-de-babado, tiririca-de-balaio, tiririca-de-bêbado, três - espigas, vassoura; carqueja (castelhano); caquexia (espanhol); querciuolo (italiano); carqueja, tojo (português de Portugal). .
PROPRIEDADES MEDICINAIS
Amarga, antianêmica, antiasmática, antibiótica, antidiarréica, antidiabétíca, antidispéptica, antigripal, anti-hidrópica, antiinflamatória, anti-reumática, anti-Trypanosoma cruzi (causador da moléstia de Chagas), aromática, colagoga, depurativa, digestivo, diurético, emoliente, eupéptica, estimulante hepática, estomáquica, febrífuga, hepato-protetor, hipocolesterolêmica, hipoglicêmica, laxante, moluscocida (contra Biomplalaria glabrata, hospedeiro intermediário do Schistosoma mansoni, causador da esquistossomose), sudorífera, tenífuga, tônico, vermífuga.
INDICAÇÃO MEDICINAL
Afecções febris, afecções gástricas, intestinais, das vias urinárias, hepáticas e biliares (icterícia, cálculos biliares, etc.); afta, amidalite, anemia, angina, anorexia, asma, astenia, azia, bronquite asmática, chagas venéreas, coadjuvante em regimes de emagrecimento, colesterol (redução de 5 a 10%.), desintoxicação do fígado, diabete, diarréias, dispepsias; doenças venéreas; enfermidades da bexiga, do fígado, dos rins, do pâncreas e do baço; espasmo, esterilidade feminina, estomatite, faringite, feridas, problemas intestinais, garganta, gastrite, gastrenterites, gengivite, gota, hidropisia, impotência sexual masculina, inflamações de garganta, inflamação das vias urinárias, intestino solto, lepra, má-digestão, mal estar, má-circulação, obesidade, prisão de ventre, reumatismo, úlceras (uso externo), vermes.
CONSTITUINTES QUÍMICOS
Segundo a EPAGRI: alfa e beta-pineno, álcoois sesquiterpênicos, ésteres terpênicos, flavonas, flavanonas, saponinas, flavonóides, fenólicos, lactonas sesquiterpênicas e tricotecenos, alcalóides. Compostos específicos: apigenina, dilactonas A, B e C, diterpeno do tipo eupatorina, germacreno-D, hispidulina, luteolina, nepetina e quercetina.
O óleo essencial contém monoterpenos (nopineno, carquejol e acetato de carquejilo). Flavonóides (apigenina, cirsiliol, cirsimantina, eriodictiol, eupatrina e genkawanina), sesquiterpenos, diterpenos, Lignanas, alfa e beta pineno, canfeno, carquejol, acetato de carquejilo, ledol, álcoois sesquiterpênicos, sesquiterpenos bi e tri cíclicos, calameno, elemol, eudesmol, palustrol, nerotidol, hispidulina, campferol, quercetina e esqualeno.
Apigenina
Contra-indicações/cuidados:
Gestantes e lactantes. Doses excessivas podem abaixar a pressão.
BIBLIOGRAFIA
Ana H. Januário, Simone L. Santos, Silvana Marcussi, Maurício V. Mazzi, Rosemeire C.L.R. Pietro, Daisy N. Sato, Javier Ellena, Suely V. Sampaio, Suzelei C. França, Andreimar M. Soares. 2004. Neo-clerodane diterpenoid, a new metalloprotease snake venom inhibitor from Baccharis trimera (Asteraceae): anti-proteolytic and anti-hemorrhagic properties. Chemico-Biological Interactions. 150 (3): 243-251.
Antônio Carlos P. Oliveira, Denise C. Endringer, Luiz Alberto S. Amorim, Maria das Graças L. Brandão, Márcio M. Coelho. 2005. Effect of the extracts and fractions of Baccharis trimera and Syzygium cumini on glycaemia of diabetic and non-diabetic mice. Journal of Ethnopharmacology. 102 (3): 465-469.
Bruce B. Jarvis, Nahid Mokhtari-Rejali, Eloir P. Schenkel, Claudio S. Barros, Nelson Ivo Matzenbacher. 1991. Trichothecene mycotoxins from Brazilian Baccharis species. Phytochemistry. 30 (3): 789-797.
C. Zdero, F. Bohlmann, J. C. Solomon, R. M. King, H. Robinson. 1989. ent-clerodanes and other constituents from bolivian Baccharis species. Phytochemistry. 28 (2): 531-542.
Ferdinand Bohlmann, Werner Knauf, Robert M. King, Harold Robinson. 1989. Ein neues diterpen und weitere inhaltsstoffe aus Baccharis-arten. Phytochemistry. 18 (6): 1011-1014.
Flávia Aparecida Resende, Jacqueline Morais Alves, Carla Carolina Munari, Juliana Marques Senedese, João Paulo B. Sousa, Jairo Kenupp Bastos, Denise Crispim Tavares. 2007. Inhibition of doxorubicin-induced mutagenicity by Baccharis dracunculifolia. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 634 (1-2): 112-118.
João Henrique G. Lago, Paulete Romoff, Oriana A. Fávero, Fátima O. Souza, Marisi G. Soares, Patrícia T. Baraldi, Arlene G. Corrêa. 2008. Chemical composition of male and female Baccharis trimera (Less.) DC. (Asteraceae) essential oils. Biochemical Systematics and Ecology. 36 (9): 737-740.
Luce Maria Brandão Torres, Maria Thereza Gamberini, Nídia F. Roque, Maria Teresa Lima-Landman, Caden Souccar, Antonio José Lapa. 2000. Diterpene from Baccharis trimera with a relaxant effect on rat vascular smooth muscle. Phytochemistry. 55 (6): 617-619.
M.J. Abad, A.L. Bessa, B. Ballarin, O. Aragón, E. Gonzales, P. Bermejo. 2006. Anti-inflammatory activity of four Bolivian Baccharis species (Compositae). Journal of Ethnopharmacology. 103 (3): 338-344.
Maria Jose Abad Martinez, Ana Latourrette Bessa, Paulina Bermejo Benito. 2005. Biologically active substances from the genus Baccharis L. (Compositae). Studies in Natural Products Chemistry. 30: 703-759.
Simone Reschke Mendes Grance, Maria Araújo Teixeira, Roseana Silveira Leite, Eurípedes Batista Guimarães, João Máximo de Siqueira, Wander Fernando de Oliveira Filiu, Simone. 2008. Baccharis trimera: Effect on hematological and biochemical parameters and hepatorenal evaluation in pregnant rats. Journal of Ethnopharmacology. 117 (1): 28-33.
________________________________________________________________________________
Yucca
Yucca elephantipes Regel (Agavaceae)
Sinónimo: Yucca guatemalensis
Yucca elephantipes Regel, é um arbusto semilenhoso de tronco dilatado na base. Tem origem na América Central e do Norte, mais precisamente na Guatemala e no México.
Tolerante a solos áridos e usada no paisagismo em plantios isolados ou formando renques a pleno sol. Mutiplica-se por sementes, mas principalmente por estaquias. As flores cerosas são utilizadas em arranjos.
Distribuição
A distribuição natural do gênero Yucca (49 espécies e 24 subespécies) abrange uma vasta área do continente norte e centro-americano. Da baixa Califórnia, no oeste, no sudoeste do norte U.S.A., tanto norte como o Canadá (província Alberta, Yucca glauca sp. Albertana), e que se desloquem ao longo do leste do Golfo do México, e depois norte novamente, através do Atlântico costeiro e interiores nos estados vizinhos.
Ao sul, o gênero é representado por todo México, e se estende em Guatemala (Yucca elephantipes). Yuccas se adaptou a uma gama tão vasta de condições climáticas e ecológicas. Elas encontram-se em desertos rochosos e Badlands, em prados e pastagens, em regiões montanhosas, em função de floresta, na areia do litoral (Yucca filamentosa), e ainda no subtropical e semi-zonas temperadas, embora este seja quase sempre árido ao semi-árido.
Sarsapogenina
BIBLIOGRAFIA
Jerry A. Powell. 1992. Interrelationships of yuccas and yucca moths. Trends in Ecology & Evolution. 7 (1): 10-15.
Kimiko Nakano, Tokushi Yamasaki, Yukiko Imamura, Kōtarō Murakami, Yoshihisa Takaishi, Toshiaki Tomimatsu. 1989. The steroidal glycosides from the caudex of Yucca gloriosa. Phytochemistry. 28 (4): 1215-1217.
Martín A. Iglesias-Arteaga, Gustavo A. Velázquez-Huerta. 2005. Favorskii rearrangement of 23-oxo-3-epi-smilagenin acetate induced by iodosobenzene. Tetrahedron Letters. 46(40): 6897-6899.
Nordin H. Lajis, A. Salam H. Abdullah, S. Jalaludin S. Salim, John B. Bremmer, Mohammad Niyaz Khan. 1993. Epi-Sarsasapogenin and epi-smilagenin: two sapogenins isolated from the rumen content of sheep intoxicated by Brachiaria decumbens. Steroids. 58 (8): 387-389.
Norito Kaneda, Hiroyuki Nakanishi, E. John Staba. 1987. Steroidal constituents of Yucca shidigera plants and tissue cultures. Phytochemistry. 26 (5): 1425-1429.
Olle Pellmyr, Kari A. Segraves, David M. Althoff, Manuel Balcázar-Lara, James Leebens-Mack. 2007. The phylogeny of yuccas. Molecular Phylogenetics and Evolution. 43(2): 493-501.
R.L.M. Pierik, H.H.M. Steegmans. 1983. Vegetative propagation of a chimerical Yucca elephantipes Regel in vitro. Scientia Horticulturae. 21 (3): 267-272.
S. J. Stohs, J. J. Obrist. 1975. Sapogenins of Yucca glauca seed pods. Phytochemistry. 14 (1): 239-241.
X. Laqueille, S. Martins. 2008. L’Ayahuasca : clinique, neurobiologie et ambiguïté thérapeutique. Annales Médico-psychologiques, revue psychiatrique. 166 (1): 23-27.
Yaer Hu, Zimei Wang, Rui Zhang, Pingping Wu, Zongqin Xia, Antonia Orsi, Daryl Rees. 2008. Regulation of M1-receptor mRNA stability by smilagenin and its significance in improving memory of aged rats. Neurobiology of Aging, 1.
Ying Zhang, Ying-Jun Zhang, Melissa R. Jacob, Xing-Cong Li, Chong-Ren Yang. 2008. Steroidal saponins from the stem of Yucca elephantipes. Phytochemistry. 69 (1): 264-270.
Ying Zhang, Ying-Jun Zhang, Melissa R. Jacob, Xing-Cong Li, Chong-Ren Yang. 2008. Steroidal saponins from the stem of Yucca elephantipes. Phytochemistry. 69 (1): 264-270.
Yongfang Zhang, Zongqin Xia, Yaer Hu, Antonia Orsi, Daryl Rees. 2008. Role of glial cell derived neurotrophic factor in the protective effect of smilagenin on rat mesencephalic dopaminergic neurons damaged by MPP+. FEBS Letters. 582 (6): 956-960.
Assinar:
Postagens (Atom)